ЭЛЕКТРОННЫЕ ОБОЛОЧКИ АТОМОВ
— строение электронных оболочек атомов определяется 4 квантовыми числами п,
1,т1 и ms,
принципом Паули
и учетом стремления электронов к нахождению на возможно минимальном энергетическом уровне.
В зависимости от п — главного квантового числа,
изменяющегося в порядке натурального ряда чисел,
электроны располагаются в определенном слое,
а в зависимости от l — побочного квантового числа — в подслое.
Число l зависит от п и изменяется от 0 до п — 1.
ml — магнитное (орбитальное) квантовое число изменяется от — l до + l,
ms — спиновое магнитное квантовое число—может иметь значение либо 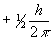 , либо
, либо 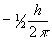 .
В зависимости от l электроны имеют разл. конфигурацию своего облака.
При l = 0,
ml тоже = 0 и облако шарообразное. В таком состоянии электроны называют s-электронами.
При l = 1,
ml может быть --1 и +1,
что означает ориентированность электронного облака и его форму,
напоминающую в разрезе цифру 8,
это — р-электроны. При l = 2,
ml может быть —2,
—1,
+1,
+2,
что также означает ориентированность облака,
но более сложной конфигурации в виде 2 перекрещивающихся восьмерок,
это — d-электроны и т. д. В каждом состоянии s,
p,
d или f может находиться либо один,
неспаренный,
электрон с ms ½ или —½ или два,
спаренные,
с замкнутыми ms-спинмомеитами. В зависимости от s-,
p-, d-состояния электроны могут образовать разл.
связи: ненаправленные за счет s-электронов и направленные за счет р- и d-электронов.
Последнее весьма важно,
так как нередко определяет важнейший элемент строения хим. соединения — координационное число.
Хим. связь образуется за счет спаривающихся или спаренных электронов.
.
В зависимости от l электроны имеют разл. конфигурацию своего облака.
При l = 0,
ml тоже = 0 и облако шарообразное. В таком состоянии электроны называют s-электронами.
При l = 1,
ml может быть --1 и +1,
что означает ориентированность электронного облака и его форму,
напоминающую в разрезе цифру 8,
это — р-электроны. При l = 2,
ml может быть —2,
—1,
+1,
+2,
что также означает ориентированность облака,
но более сложной конфигурации в виде 2 перекрещивающихся восьмерок,
это — d-электроны и т. д. В каждом состоянии s,
p,
d или f может находиться либо один,
неспаренный,
электрон с ms ½ или —½ или два,
спаренные,
с замкнутыми ms-спинмомеитами. В зависимости от s-,
p-, d-состояния электроны могут образовать разл.
связи: ненаправленные за счет s-электронов и направленные за счет р- и d-электронов.
Последнее весьма важно,
так как нередко определяет важнейший элемент строения хим. соединения — координационное число.
Хим. связь образуется за счет спаривающихся или спаренных электронов.
|

