ЦИАНУРОВАЯ КИСЛОТА
(2,4,6-тригидрокси-1,3,5-триазин),
мол. м. 129,1; бесцв. кристаллы; т. пл. > 360 °С (с разл.); 1,758; Ср 176,6 Дж/(моль х К) при 25 °С;
1,758; Ср 176,6 Дж/(моль х К) при 25 °С;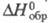 -690,8 кДж/моль,
-690,8 кДж/моль,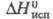 160,2 кДж/моль,
160,2 кДж/моль,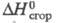 -918,4 кДж/моль. Р-римость в воде (г/л) при 25,50 и 90 °С соотв. 2,7 и
26; р-римость в бензоле, ДМФА, ДМСО при 25 °С соотв. 2,3, 67 и 151 г/л;
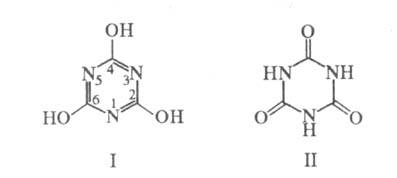
не раств. в ацетоне, спиртах, диэтиловом эфире. Может существовать в виде
лактимной (циануровая к-та; ф-ла I) и лактамной форм (изоциануровая к-та,
или триазинтрион; ф-ла II):
-918,4 кДж/моль. Р-римость в воде (г/л) при 25,50 и 90 °С соотв. 2,7 и
26; р-римость в бензоле, ДМФА, ДМСО при 25 °С соотв. 2,3, 67 и 151 г/л;
не раств. в ацетоне, спиртах, диэтиловом эфире. Может существовать в виде
лактимной (циануровая к-та; ф-ла I) и лактамной форм (изоциануровая к-та,
или триазинтрион; ф-ла II):
Константы ионизации формы II К1,
К2 , К3(вода, 25 °С) соотв. 6,3 х 10-7,
7,8 х 10-11, 3,2 х 10-14.
Ц. к. при нагр. выше 360 °С разлагается
до циановой к-ты. При взаимод. с NH3 под давлением при 200-250
°С образует моноаммониевую соль, выше 250 °С - цианурамид (4-амино-2,6-дигидрокси-1,3,5-триазин,
аммелид); при нагр. с НС1 разлагается с выделением СО2 и NH3.
Взаимод. Ц. к. с гидроксидами металлов I, II и IV фупп приводит к одно-,
двух- и трехзамещенным солям - циануратам. Цианурат Na в водном р-ре при
взаимод. с С12 превращается в 1,3,5-трихлоризоциануровую к-ту.
Ц. к. под давлением при повышенной т-ре в присут. РС15 образует
цианурхлорид (2,4,6-трихлор-1,3,5-триазин, т. пл. 154 °С). При взаимод.
с этиленоксидом, аллилхлоридом и бензилхлоридом Ц. к. превращается соотв.
в 1,3,5-трмс-(2-гидроксиэтил)-, триаллил- и трибензилпроизводные изоциануровой
к-ты.
Получают Ц. к. гл. обр. пиролизом мочевины;
другие способы получения - нагревание мочевины в присут. С12,
СОС12, SO2C12, гидролиз цианурхлорида
и меламина.
Определяют Ц. к. методом потенциометрич.
титрования щелочи, выделившейся при осаждении меламином Ц. к. из ее соли.
Ц. к., цианурхлорид и другие производные
применяют для получения эффективных отбеливающих и дезинфицирующих ср-в,
полимеров, используют в качестве фунгицидов, гербицидов, антипиренов, клеев;
триаллильное производное изоциануровой к-ты - сшивающий агент и стабилизатор
ПВХ.
Токсич. действие Ц. к. незначительно;
производные Ц. к., напр. аминопроизводные, более токсичны. Для триаллилпроизводного
изоциануровой к-ты ЛД50 438 мг/кг (мыши, внутрижелудочно). ПДК
для Ц. к. 0,5 мг/см3 (в водоемах хозяйств.-бытового пользования
6 мг/л), для цианурхлорида 0,1 мг/м3.
Лит.: Smolin E. M., Rapoport L.I.,
S Triazines and derivatives, N. Y.-L., 1959, p. 17-146; Kirk-Othmer encyclopedia,
3 ed., v. 7, N. Y., 1979, p. 397-410.
C. С. Рукевич, В. И. Заграничный.
Ц. к. и ее производные вступают в р-цию
с карбонильными соед. в условиях Кнёвенагеля
[Кневенагеля] реакции
, напр.:
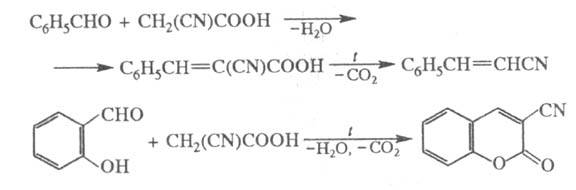
Р-ция Ц. к. и ее эфиров с мочевиной и ее
производными приводит к азотсодержащим гетероциклам, напр, с 1,3-диметилмочевиной
образуется 1,3-диметил-4-иминоурацил - полупродукт в синтезе пуриновых
алкалоидов (теофиллина, кофеина):
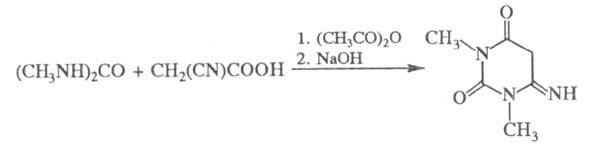
Р-цией этилового эфира Ц. к. с мочевиной
получают 2,4-дигидрокси-6-аминопиримидин:
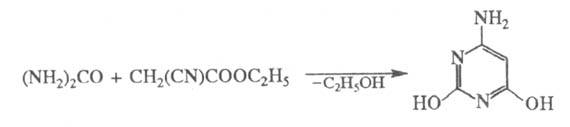
В пром-сти и лаборатории Ц. к. получают
взаимод. хлорацетата Na с NaCN в водной среде при 80-85 °С:

|

