ЦИАНЭТИЛИРОВАНИЕ
( цианэтилирование),
введение в молекулу
цианэтилирование),
введение в молекулу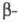 цианэтильной
группы. Осуществляется действием акрилонитрила на спирты, фенолы, тиолы
и др. соед. с подвижным атомом Н в присут. основных катализаторов (щелочи,
алкоголяты и др.) в среде орг. р-рителя (бензол, ацетонитрил и др.). В
нек-рых случаях катализаторами могут служить к-ты.
цианэтильной
группы. Осуществляется действием акрилонитрила на спирты, фенолы, тиолы
и др. соед. с подвижным атомом Н в присут. основных катализаторов (щелочи,
алкоголяты и др.) в среде орг. р-рителя (бензол, ацетонитрил и др.). В
нек-рых случаях катализаторами могут служить к-ты.
Ц.- частный случай Михаэля реакции
.
Ц.
протекает через промежут. образование карбаниона; последний в избытке акрилонитрила
способен к присоединению еще одной молекулы нитрила, напр.:
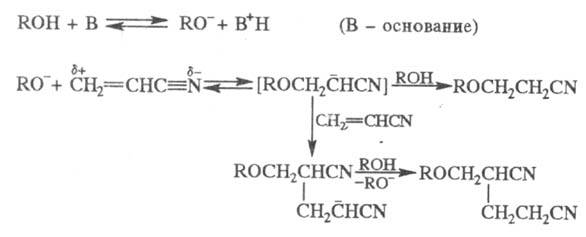
Р-ция с первичными спиртами - экзотермическая,
вторичные спирты реагируют труднее первичных, третичные в обычных условиях
в р-цию не вступают. Подобно одноатомным спиртам реагируют гликоли и многоатомные
спирты, а также этиленциангидрин, оксимы, аминоспирты. Для последних при
наличии в аминогруппе свободного атома водорода р-ция идет по атому азота.
Фенолы цианэтилируются по гидроксильной
группе и в ядро, напр.:
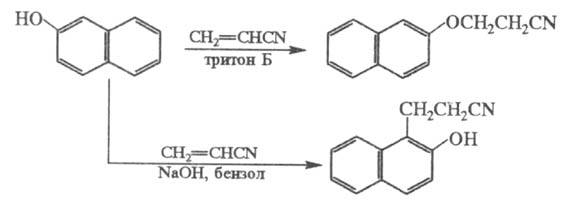
Электроотрицат. группы препятствуют р-ции;
так, выход продукта Ц. n-хлорфенола менее 10%.
Тиолы реагируют с ахрилонитрилом более
энергично, чем спирты. Ц. алифатич. и ароматич. тиолов приводит к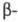 алкил(арил)тиопропионитрилам
RSCH2CH2CN, Ц. гидросульфитов и сульфинатов - к производным
S(VI):
алкил(арил)тиопропионитрилам
RSCH2CH2CN, Ц. гидросульфитов и сульфинатов - к производным
S(VI):
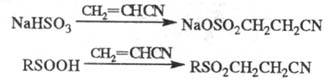
При Ц. сероводорода образуется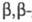 дицианодиэтилсульфид
S(CH2CH2CN)2. Аналогично реагирует вода.
дицианодиэтилсульфид
S(CH2CH2CN)2. Аналогично реагирует вода.
Ц. аммиака в зависимости от условий приводит
к продуктам моно-, ди- и трицианэтилирования (р-ция обратимая). Первичные
амины цианэтилируются в отсутствие катализатора, труднее идет р-ция с циклич.
вторичными аминами (напр., пиперидином, морфолином) и еще труднее с ациклич.
вторичными аминами. Ароматич. амины вступают в р-цию при повышенной т-ре
в присут. кислот (H2SO4, ледяная СН3СООН
и др.); ускоряют р-цию соли Сu, Zn, Co, Ni.
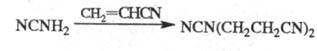
При Ц. цианамида в присут. водной щелочи
образуется продукт бисцианэтилирования, обладающий сильным инсектицидным
действием:
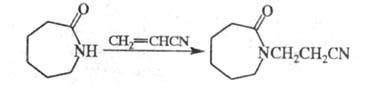
Циклич. амиды, особенно имиды, в присут.
щелочей довольно легко цианэтилируются по иминогруппе:
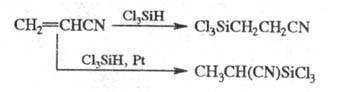
В присут. оснований силаны реагируют с
акрилонитрилом по механизму цианэтилирования;
в присут. Pt направление р-ции меняется:
цианэтилирования;
в присут. Pt направление р-ции меняется:
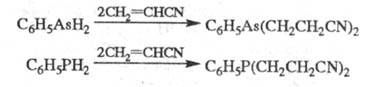
Незамещ. фосфин цианэтилируется, подобно
аммиаку, Ц. первичных фосфинов и арсинов приводит к бис- -цианэтилзамещенным
соед.:
-цианэтилзамещенным
соед.:
Гладко идет Ц. галогеноводородов с образованием
HalCH2CH2CN, синильной к-ты - с образованием сукцинонитрила
NCCH2CH2CN.
Ц. применяют в пром-сти для получения
сукцинонитрила, а также для модификации св-в нек-рых полимеров (крахмала,
целлюлозы и др.).
Лит.: Терентьев А.П., Кост А.Н.,
в кн.: Реакции и методы исследования органических соединений, кн. 2, М-
Л., 1952, с. 47-208; Kirk-Othmer encyclopedia, 3 ed., v. 7, N. Y., 1979,
p. 370-85.
С. К. Смирнов, С. С. Смирнов.

