ЦИКЛОФАНЫ
(фаны), мостиковые макроциклич.
системы, включающие ароматич. и (или) гетероароматич. кольца, соединенные
между собой алифатич. цепочками.
Первоначально Ц. наз. системы, включающие
бензольные кольца, связанные по пара-
или мета
-положениям
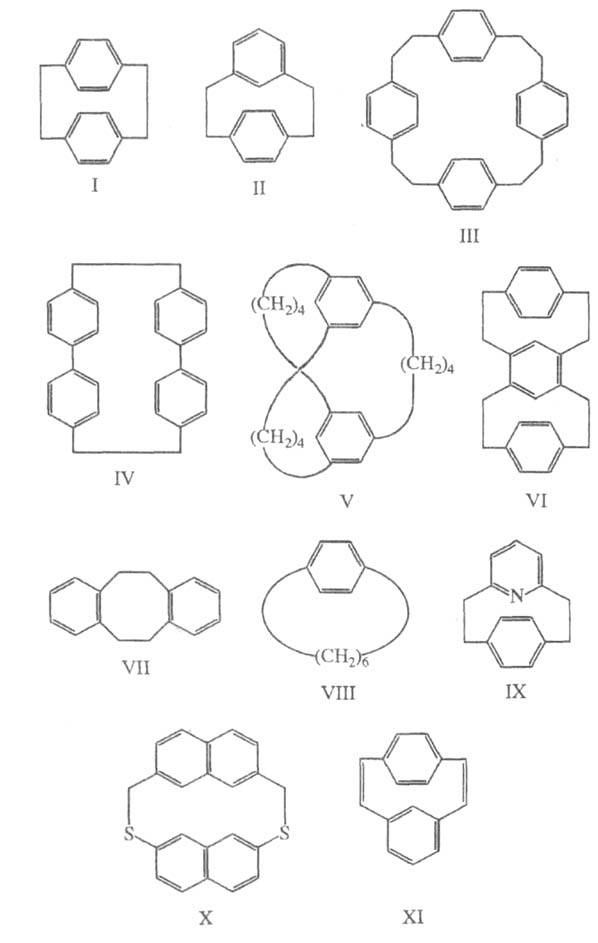
полиметиленовыми цепочками (соед. I-VI). В настоящее время к Ц. относят
также конденсированные системы с орто-
расположенными мостиками (VII);
соед., содержащие одно ароматич. (гетероароматич.) кольцо с одним мостиком
(VIII, анса-соединения); соед. с гетероароматич. (IX) или небензоидными
ароматич. кольцами; системы, в к-рых одна или неск. мети-леновых групп
заменены гетероатомами либо содержат в алифатич. цепочках разл. функц.
группы и кратные связи (X, XI). Различают Ц., содержащие только ароматич.
кольца (карбофаны), гетероароматич. (гетерофаны) и смешанные циклофаны.
Ц., содержащие в алифатич. цепочках гетероатомы, наз. гетерофанами.
Номенклатура. Систематич. названия
карбофанов, включающих только бензольные кольца, содержат в качестве основы
"циклофан", перед основой помещают цифры (в квадратных скобках), кол-во
их соответствует числу мостиков, а значения - числу метиленовых групп,
и префикс(ы) орто-, мета- и пара-, обозначающие тип замещения в бензольных
кольцах, напр. [2.2] парациклофан (I), [2.2]метапарациклофан (II), [2.2.2.2]парациклофан
(III), [2.0.2.0]парациклофан (IV), [2.2]ортоциклофан (VII), [6]парациклофан
(VIII). Назв. Ц., включающих ароматич. кольца, отличные от бензольного,
а также гетероароматич. кольца, содержат назв. соответствующего цикла с
окончанием "фан", перед к-рым в круглых скобках цифрами записывают положения
атомов цикла, к к-рым присоединен мостик, напр. 1,12-дитиа-[2.2](2,7)нафгалинофан
(X). При наличии в молекуле разл. ароматич. (гетероароматич.) колец их
назв. указывают последовательно и используют окончание "фан", напр. [2]парацикло[2](2,6)пиридинофан
(IX). В назв. Ц., содержащих более двух мостиков, а также т. наз. слоистых
или многослойных Ц. префиксы орто-, мета- и пара- не используют, а применяют
цифровую систему обозначений, напр. [4.4.4](1,3,5)циклофан (V), [2.2](1,4)(1,3)[2.2](4,6)(1,4)циклофан
(VI).
Наличие в Ц. заместителей или кратных связей
указывают в их назв. с использованием обычных суффиксов и префиксов, напр.
[2.2]метапарациклофан-1,9-диен (XI). Названия Ц., имеющих цепочки одинаковой
длины, м. б. записаны сокращенно, напр. [24]парациклофан (III).
Нек-рые Ц. имеют тривиальные назв., напр. производные [1.1.1.1](2,5)пирролофана
- порфирины
, а [1.1.1.0](2,5)пирролофана - коррины
(см. Корриноиды
); большая группа
гидроксилированных [1n]метациклофанов - производных
пара
-замещенных
фенолов - носит назв. каликсарены, что отражает их пространств. строение
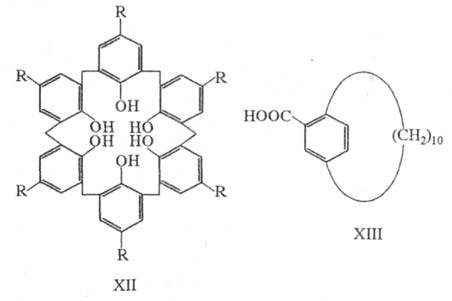
(от лат. calix - чаша, кубок), напр. каликс[6]арен (XII).
Свойства Ц. обусловленны напряженностью
молекул и трансаннулярным взаимод. -электронной
ареновой или гетареновой системы с др. кольцом, фрагментом мостика или
заместителем на "противоположной" стороне макроцикла. В низших [2.2]пара-
и метациклофанах и [3.3]пара- и метацик-лофанах наблюдается даже искажение
планарности бензольных колец. Невозможность вращения ароматич. кольца в
Ц. приводит к существованию нек-рых монозамещенных, напр. кислоты ХIII,
в виде оптич. изомеров. Функциональные замещенные Ц. проявляют способность
к образованию комплексов с ионами и молекулами по типу "хозяин - гость".
Нек-рые из этих комплексов по сродству к ионам напоминают краун-эфиры.
Напр., каликсарен XII (R = COOH) обладает значительно более высоким сродством
и селективностью по отношению к катиону уранила по сравнению с др. соед.;
такие Ц. могут быть использованы для извлечения металлов из морской воды.
Синтезированы комплексы, содержащие фрагменты Ц. и краун-эфиров (кавитанды,
карцеранды), представляющие интерес как системы для мол. распознавания.
-электронной
ареновой или гетареновой системы с др. кольцом, фрагментом мостика или
заместителем на "противоположной" стороне макроцикла. В низших [2.2]пара-
и метациклофанах и [3.3]пара- и метацик-лофанах наблюдается даже искажение
планарности бензольных колец. Невозможность вращения ароматич. кольца в
Ц. приводит к существованию нек-рых монозамещенных, напр. кислоты ХIII,
в виде оптич. изомеров. Функциональные замещенные Ц. проявляют способность
к образованию комплексов с ионами и молекулами по типу "хозяин - гость".
Нек-рые из этих комплексов по сродству к ионам напоминают краун-эфиры.
Напр., каликсарен XII (R = COOH) обладает значительно более высоким сродством
и селективностью по отношению к катиону уранила по сравнению с др. соед.;
такие Ц. могут быть использованы для извлечения металлов из морской воды.
Синтезированы комплексы, содержащие фрагменты Ц. и краун-эфиров (кавитанды,
карцеранды), представляющие интерес как системы для мол. распознавания.
Получение. Ц. получают из производных
ароматич. и гетероароматич. соединений. Так, [2.2]парациклофан м. б. синтезирован
из 4,4-дибромметил-1,2-дифенилэтана по р-ции Вюрца. Для получения высших
парациклофанов используют циклизацию сложных эфиров в условиях внутримол.
ацилоиновой конденсации. Специфич. метод получения [2.2]парациклофанов,
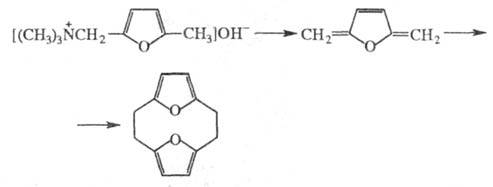
[2,2]ортоциклофанов и их аналогов -расщепление четвертичных аммониевых
оснований по р-ции Гофмана, напр.:
Второй путь синтеза - построение структуры
Ц. на основе алициклич. или гетероциклич. систем. Напр., [6]метациклофан
м. б. получен из конденсир. алициклич. системы, включающей 5- и 8-членные
циклы, а [8]пирролофан - из циклододекан-1,4-диона:
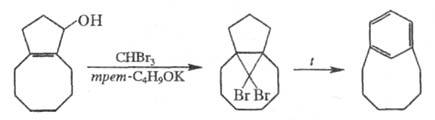
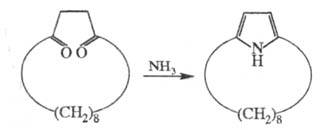
Третий путь синтеза - превращение одних
Ц. в другие. При этом наиб. значение имеет экструзия SO2 из
макроциклич. сульфонов либо фотолитич. экструзия серы из тиациклофанов.
Напр., пиридинофан XIV получают по схеме:
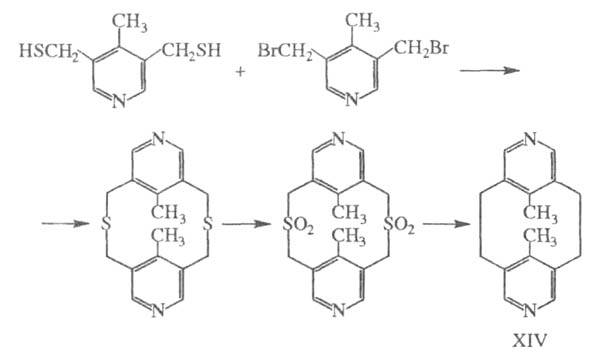
Соед. ф-лы II м. б. получено изомеризацией
соед. I под действием А1С13.
Применение. Перспективные области
использования Ц.-создание искусств. ферментов и рецепторов, электропроводящих
орг. материалов, ион-селективных электродов, катализаторов фазового переноса,
систем для разделения молекул путем захвата во внутр. полость частиц лишь
определенных размеров и др. Нек-рые полимерные Ц. обладают св-вами комплексов
с переносом заряда.
Лит.: Гольдфарб Я. Л., Беленький
Л. И., "Успехи химии", 1957, т. 26, в. 3, с. 362-87; Общая органическая
химия, пер. с англ., т. 1, М., 1981, с. 437-42; Новое в жизни, науке и
технике, сер. Химия, 1989, № 1,2; Vоgtle F., NeumannP., "Synthesis", 1973,
№2, p. 85-103; Ferguson J., "Chem. Rev.", 1986, v. 86, № 6, p. 957-82.
Л. И. Беленький.

