ЦИРКОНИЯ ГАЛОГЕНИДЫ
. Дигалогениды
ZrX2 - черные кристаллы (табл.). Тригалогениды ZrX3
- голубовато-серые, темно-синие или черные кристаллы, к-рые могут существовать
в сравнительно широких областях гомогенности, диспропорционируют или разлагаются
при натр., легко окисляются на воздухе, не раств. в воде; получают их восстановлением
соответствующих тетрагалогенидов. Тетрагалогениды ZrX4 -бесцв.
кристаллы, гидролизуются водой (ZrF4 - медленно). Галогеноцирконаты(IV)
- бесцв. кристаллы.
Тетрафторид ZrF4: 64,4 кДж/моль,
64,4 кДж/моль,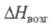 215,9 кДж/моль (1179 К); ур-ние температурной зависимости давления пара
lgр (Па) = 15,6818 - 12430/Т (681-913 К); умеренно раств.
в воде (15 г/л), лучше - в разб. к-тах; образует моно- и тригидрат, фтороциркониевые
к-ты (фтороцирконаты гидроксония), напр. HZrF5 х nH2O,
H2ZrF6 х nH2O, (H3O)2ZrF6,
многочисленные фтороцирконаты, напр. NH4ZrF5, K2ZrF6,
(NH4)3ZrF7, Ba2ZrF8,
K2NiZr2F12, Na5Zr3F17.
Получают из водных р-ров солей Zr(IV) действием фтористоводородной к-ты
с послед. сушкой осадка в атмосфере HF, взаимод. ZrO2 с F2
или HF при 400-500 °С, термич. разложением (NH4)2ZrP6
или (NH4)3ZrF7 при 350-450 С. Применяют
ZrF4 как промежут. в-во при металлотермич. произ-ве Zr, компонент
фтороцирконатных стекол для волоконных световодов ИК диапазона, лазеров
и хим. сенсоров.
215,9 кДж/моль (1179 К); ур-ние температурной зависимости давления пара
lgр (Па) = 15,6818 - 12430/Т (681-913 К); умеренно раств.
в воде (15 г/л), лучше - в разб. к-тах; образует моно- и тригидрат, фтороциркониевые
к-ты (фтороцирконаты гидроксония), напр. HZrF5 х nH2O,
H2ZrF6 х nH2O, (H3O)2ZrF6,
многочисленные фтороцирконаты, напр. NH4ZrF5, K2ZrF6,
(NH4)3ZrF7, Ba2ZrF8,
K2NiZr2F12, Na5Zr3F17.
Получают из водных р-ров солей Zr(IV) действием фтористоводородной к-ты
с послед. сушкой осадка в атмосфере HF, взаимод. ZrO2 с F2
или HF при 400-500 °С, термич. разложением (NH4)2ZrP6
или (NH4)3ZrF7 при 350-450 С. Применяют
ZrF4 как промежут. в-во при металлотермич. произ-ве Zr, компонент
фтороцирконатных стекол для волоконных световодов ИК диапазона, лазеров
и хим. сенсоров.
Гексафтороцирконат(IV) калия K2ZrF6
умеренно раств. в воде; получают осаждением из р-ров ZrF4 или
(NH4)2ZrF6 действием солей К, в пром-сти
- взаимод. рудных цирконовых концентратов с K2SiF6
при 600-700 °С; промежут. в-во для электролитич. произ-ва Zr. Гептафтороцирконат(IV)
аммония (NH4)3ZrF7 разлагается при 300-400
°С с последоват. образованием (NH4)2ZrF6,
NH4ZrF5 и ZrF4; хорошо раств. в воде;
получают взаимод. ZrO2 с NF4HF2, при 150-200
°С; применяют для произ-ва особо чистого ZrF4 и получения др.
фтороцирконатов. Оксифториды ZrOF2, Zr3OF10,
Zr3O2F8, Zr4OF14,
Zr2OF6, Zr7O9F10 и
др.- бесцв. кристаллы; получают взаимод. ZrF4 с ZrO2,
как промежут. продукты пирогидролиза ZrF4 или фторирования ZrO2.
ХАРАКТЕРИСТИКА ГАЛОГЕНИДОВ ЦИРКОНИЯ
|
В-во
|
Сингония
|
Параметры кристаллической
решетки
|
Т. пл.,°С
|
Т. кип.,0С
|
|
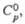
Дж/(моль х К) |
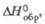
кДж/моль |
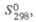
Дж/(моль х К) |
|
|
а, им
|
b,
нм
|
с, нм
|
угол, град
|
|
|
ZrF2
|
Ромбич.
|
0,409
|
0,491
|
0,656
|
—
|
902
|
Разл.
|
—
|
65,9
|
—
|
84
|
|
|
ZrF,
|
Кубич.
|
—
|
—
|
—
|
—
|
Разл.
|
—
|
4,26
|
83,7
|
—
|
105
|
|
|
ZrF4
|
Моноклинная
|
0,957
|
0,993
|
0,773
|
94,47
|
690*
|
—
|
4,55
|
103,6
|
-1911
|
104
|
|
|
Тетрагон.
|
0,7896
|
—
|
0,7724
|
—
|
910
|
906**
|
4,61
|
—
|
—
|
—
|
|
|
ZrF4
x H2O
|
Тетрагон.
|
0,7724
|
—
|
1,1678
|
—
|
Разл.
|
—
|
3,53
|
—
|
-2207
|
—
|
|
|
(H3O),ZrF6
|
Моноклинная
|
0,6715
|
0,7187
|
1,2626
|
11,83
|
Разл.
|
—
|
—
|
—
|
—
|
—
|
|
|
K2ZrF6
|
Ромбич.
|
0,661
|
0,141
|
0,697
|
—
|
240*
|
—
|
3,58
|
—
|
—
|
—
|
|
|
K3ZrF7
|
Кубич.
|
0,899
|
—
|
—
|
—
|
920
|
—
|
3,12
|
—
|
—
|
—
|
|
|
(NH4)2ZrF6
|
Ромбич.
|
—
|
—
|
—
|
—
|
138*
|
Разл.
|
—
|
234
|
-2897
|
260
|
|
|
(NH4)3ZrF7
|
Кубич.
|
0,942
|
—
|
—
|
—
|
Разл.
|
—
|
2,21
|
300
|
-3365
|
337
|
|
|
ZrCl2
|
—
|
—
|
—
|
—
|
—
|
722
|
Разл.
|
—
|
74
|
-404
|
110
|
|
|
ZrCl,
|
Гексагон.
|
—
|
—
|
—
|
—
|
—
|
770**
|
—
|
98
|
-701
|
138
|
|
|
ZrCl4
|
Моноклинная
|
0,6361
|
0,7407
|
0,6256
|
109,3
|
437
|
333,6**
|
2,80
|
120
|
-979,8
|
—
|
|
|
ТrOСl2
|
Ромбич.
|
0,9687
|
1,0589
|
0,9143
|
—
|
—
|
—
|
—
|
—
|
-1083
|
—
|
|
|
ZrBr3
|
Гексагон.
|
—
|
—
|
—
|
—
|
Разл.
|
—
|
—
|
99,6
|
-636
|
184
|
|
|
ZrBr4
|
Кубич.
|
1,095
|
—
|
—
|
—
|
450
|
355**
|
3,98
|
125
|
-760,6
|
225
|
|
|
ZrI3
|
Гексагон.
|
—
|
—
|
—
|
—
|
Разл.
|
—
|
—
|
104
|
-395
|
209
|
|
|
ZrI4
|
Кубич.
|
1,179
|
—
|
—
|
—
|
500
|
418**
|
4,85
|
123
|
-482
|
257
|
|
*Т-ра полиморфного перехода. **Т-ра возгонки.
Трихлорид ZrCl3 при нагр. диспропорционирует
с выделением ZrCl4 и последоват. образованием ZrCl2,8
(200 °С), ZiCl1,6 (300 °С), ZrCl (450 °С) и Zr (600 °С, вакуум).
Тетрахлорид ZrC4: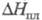 49
кДж/моль,
49
кДж/моль,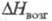 103 кДж/моль; tкрит 503,5 °С, ркрит 5,7
МПа; ур-ние температурной зависимости давления пара lg p (Пa)= 13,8-5700/Т
для твердого и lgp (Па) = 11,4 - 3500/Т для жидкого ZrCl4;
раств. в этаноле, диэтиловом эфире, образует аддукты с к-тами Льюиса (напр.,
ZrCl4 * PCl5, ZrCl4*2CH3CN
и др.), хлороцирконаты с хлоридами металлов (K2ZrCl6,
BaZrCl6 и др.). Получают ZrCl4 взаимод. Zr с С12
или НС1 выше 300 °С, ZrO2 с ССl4 или СОС12 выше
300 °С, смеси ZrO2 и С с С12 выше 600 °С, карбида
Zr с С12 выше 400 °С; используют как промежут. продукт в произ-ве
Zr, исходное в-во для магниетермич. восстановления, катализатор орг. р-ций
(напр., Фриделя-Крафтса). Гексахлороцирконат калия K2ZrCl6,
т. пл. 799 °С, т-ра полиморфного перехода 622 °С,
103 кДж/моль; tкрит 503,5 °С, ркрит 5,7
МПа; ур-ние температурной зависимости давления пара lg p (Пa)= 13,8-5700/Т
для твердого и lgp (Па) = 11,4 - 3500/Т для жидкого ZrCl4;
раств. в этаноле, диэтиловом эфире, образует аддукты с к-тами Льюиса (напр.,
ZrCl4 * PCl5, ZrCl4*2CH3CN
и др.), хлороцирконаты с хлоридами металлов (K2ZrCl6,
BaZrCl6 и др.). Получают ZrCl4 взаимод. Zr с С12
или НС1 выше 300 °С, ZrO2 с ССl4 или СОС12 выше
300 °С, смеси ZrO2 и С с С12 выше 600 °С, карбида
Zr с С12 выше 400 °С; используют как промежут. продукт в произ-ве
Zr, исходное в-во для магниетермич. восстановления, катализатор орг. р-ций
(напр., Фриделя-Крафтса). Гексахлороцирконат калия K2ZrCl6,
т. пл. 799 °С, т-ра полиморфного перехода 622 °С,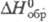 -1932 кДж/моль. Оксихлориды, напр. ZrOCl2, Zr2O3Cl2,-
бесцв. кристаллы, при нагр. выше 70 °С в водном р-ре гидролизуются; промежут.
продукты хлорирования ZrO2 или гидролиза ZrCl4, образуются
также при растворении соед. Zr в соляной к-те. Октагидрат ZrOCl2 *
8Н2О хорошо раств. в воде (67% при 25 °С) и гораздо хуже в соляной
к-те, его применяют для получения небольших партий особо чистых соед. Zr
перекристаллизацией.
-1932 кДж/моль. Оксихлориды, напр. ZrOCl2, Zr2O3Cl2,-
бесцв. кристаллы, при нагр. выше 70 °С в водном р-ре гидролизуются; промежут.
продукты хлорирования ZrO2 или гидролиза ZrCl4, образуются
также при растворении соед. Zr в соляной к-те. Октагидрат ZrOCl2 *
8Н2О хорошо раств. в воде (67% при 25 °С) и гораздо хуже в соляной
к-те, его применяют для получения небольших партий особо чистых соед. Zr
перекристаллизацией.
Тетраиодид ZrI4: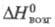 119 кДж/моль; ур-ние температурной зависимости давления пара lg р (Па)
= 22,99 -7,680/742,164 lg Т - 1,344 * 10-3 T (298-704
К), в парах выше 1200 °С разлагается до Zr; раств. в этаноле, бензоле;
получают взаимод. Zr (реже ZrO2) с I2 при 300-500
°С; промежут.
119 кДж/моль; ур-ние температурной зависимости давления пара lg р (Па)
= 22,99 -7,680/742,164 lg Т - 1,344 * 10-3 T (298-704
К), в парах выше 1200 °С разлагается до Zr; раств. в этаноле, бензоле;
получают взаимод. Zr (реже ZrO2) с I2 при 300-500
°С; промежут.
продукт при иодидном рафинировании
Zr.
Э. Г. Раков.



 64,4 кДж/моль,
64,4 кДж/моль,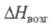 215,9 кДж/моль (1179 К); ур-ние температурной зависимости давления пара
lgр (Па) = 15,6818 - 12430/Т (681-913 К); умеренно раств.
в воде (15 г/л), лучше - в разб. к-тах; образует моно- и тригидрат, фтороциркониевые
к-ты (фтороцирконаты гидроксония), напр. HZrF5 х nH2O,
H2ZrF6 х nH2O, (H3O)2ZrF6,
многочисленные фтороцирконаты, напр. NH4ZrF5, K2ZrF6,
(NH4)3ZrF7, Ba2ZrF8,
K2NiZr2F12, Na5Zr3F17.
Получают из водных р-ров солей Zr(IV) действием фтористоводородной к-ты
с послед. сушкой осадка в атмосфере HF, взаимод. ZrO2 с F2
или HF при 400-500 °С, термич. разложением (NH4)2ZrP6
или (NH4)3ZrF7 при 350-450 С. Применяют
ZrF4 как промежут. в-во при металлотермич. произ-ве Zr, компонент
фтороцирконатных стекол для волоконных световодов ИК диапазона, лазеров
и хим. сенсоров.
215,9 кДж/моль (1179 К); ур-ние температурной зависимости давления пара
lgр (Па) = 15,6818 - 12430/Т (681-913 К); умеренно раств.
в воде (15 г/л), лучше - в разб. к-тах; образует моно- и тригидрат, фтороциркониевые
к-ты (фтороцирконаты гидроксония), напр. HZrF5 х nH2O,
H2ZrF6 х nH2O, (H3O)2ZrF6,
многочисленные фтороцирконаты, напр. NH4ZrF5, K2ZrF6,
(NH4)3ZrF7, Ba2ZrF8,
K2NiZr2F12, Na5Zr3F17.
Получают из водных р-ров солей Zr(IV) действием фтористоводородной к-ты
с послед. сушкой осадка в атмосфере HF, взаимод. ZrO2 с F2
или HF при 400-500 °С, термич. разложением (NH4)2ZrP6
или (NH4)3ZrF7 при 350-450 С. Применяют
ZrF4 как промежут. в-во при металлотермич. произ-ве Zr, компонент
фтороцирконатных стекол для волоконных световодов ИК диапазона, лазеров
и хим. сенсоров.
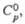
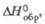
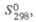
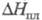 49
кДж/моль,
49
кДж/моль,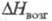 103 кДж/моль; tкрит 503,5 °С, ркрит 5,7
МПа; ур-ние температурной зависимости давления пара lg p (Пa)= 13,8-5700/Т
для твердого и lgp (Па) = 11,4 - 3500/Т для жидкого ZrCl4;
раств. в этаноле, диэтиловом эфире, образует аддукты с к-тами Льюиса (напр.,
ZrCl4 * PCl5, ZrCl4*2CH3CN
и др.), хлороцирконаты с хлоридами металлов (K2ZrCl6,
BaZrCl6 и др.). Получают ZrCl4 взаимод. Zr с С12
или НС1 выше 300 °С, ZrO2 с ССl4 или СОС12 выше
300 °С, смеси ZrO2 и С с С12 выше 600 °С, карбида
Zr с С12 выше 400 °С; используют как промежут. продукт в произ-ве
Zr, исходное в-во для магниетермич. восстановления, катализатор орг. р-ций
(напр., Фриделя-Крафтса). Гексахлороцирконат калия K2ZrCl6,
т. пл. 799 °С, т-ра полиморфного перехода 622 °С,
103 кДж/моль; tкрит 503,5 °С, ркрит 5,7
МПа; ур-ние температурной зависимости давления пара lg p (Пa)= 13,8-5700/Т
для твердого и lgp (Па) = 11,4 - 3500/Т для жидкого ZrCl4;
раств. в этаноле, диэтиловом эфире, образует аддукты с к-тами Льюиса (напр.,
ZrCl4 * PCl5, ZrCl4*2CH3CN
и др.), хлороцирконаты с хлоридами металлов (K2ZrCl6,
BaZrCl6 и др.). Получают ZrCl4 взаимод. Zr с С12
или НС1 выше 300 °С, ZrO2 с ССl4 или СОС12 выше
300 °С, смеси ZrO2 и С с С12 выше 600 °С, карбида
Zr с С12 выше 400 °С; используют как промежут. продукт в произ-ве
Zr, исходное в-во для магниетермич. восстановления, катализатор орг. р-ций
(напр., Фриделя-Крафтса). Гексахлороцирконат калия K2ZrCl6,
т. пл. 799 °С, т-ра полиморфного перехода 622 °С,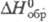 -1932 кДж/моль. Оксихлориды, напр. ZrOCl2, Zr2O3Cl2,-
бесцв. кристаллы, при нагр. выше 70 °С в водном р-ре гидролизуются; промежут.
продукты хлорирования ZrO2 или гидролиза ZrCl4, образуются
также при растворении соед. Zr в соляной к-те. Октагидрат ZrOCl2 *
8Н2О хорошо раств. в воде (67% при 25 °С) и гораздо хуже в соляной
к-те, его применяют для получения небольших партий особо чистых соед. Zr
перекристаллизацией.
-1932 кДж/моль. Оксихлориды, напр. ZrOCl2, Zr2O3Cl2,-
бесцв. кристаллы, при нагр. выше 70 °С в водном р-ре гидролизуются; промежут.
продукты хлорирования ZrO2 или гидролиза ZrCl4, образуются
также при растворении соед. Zr в соляной к-те. Октагидрат ZrOCl2 *
8Н2О хорошо раств. в воде (67% при 25 °С) и гораздо хуже в соляной
к-те, его применяют для получения небольших партий особо чистых соед. Zr
перекристаллизацией.
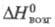 119 кДж/моль; ур-ние температурной зависимости давления пара lg р (Па)
= 22,99 -7,680/742,164 lg Т - 1,344 * 10-3 T (298-704
К), в парах выше 1200 °С разлагается до Zr; раств. в этаноле, бензоле;
получают взаимод. Zr (реже ZrO2) с I2 при 300-500
°С; промежут.
119 кДж/моль; ур-ние температурной зависимости давления пара lg р (Па)
= 22,99 -7,680/742,164 lg Т - 1,344 * 10-3 T (298-704
К), в парах выше 1200 °С разлагается до Zr; раств. в этаноле, бензоле;
получают взаимод. Zr (реже ZrO2) с I2 при 300-500
°С; промежут.