ДЕТАЛЬНОГО РАВНОВЕСИЯ ПРИНЦИП
в
химической кинетике, связывает кинетич. характеристики прямого и обратного микроскопич. процессов (квантового перехода или элементарной хим. р-ции), происходящих при соударениях частиц (атомов, молекул). В рамках динамич. описания системы взаимодействующих частиц, при к-ром вероятность процесса определяется энергией каждой частицы, изменение энергии при соударениях характеризуется сечением перехода или сечением р-ции (см. Столкновений теория
). Переходы частицы из начального квантового состояния а в конечное b и обратно происходят при определенных значениях энергии относит. движения частиц (соотв. Eat и Ebt). Внутр. энергия частицы в обоих рассматриваемых состояниях (соотв. Еа и Eb) связана с Eat и Ebt законом сохранения:
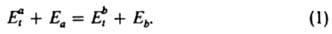
Д. р. п. устанавливает след. соотношение между сечениями 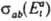 и
и 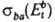 прямого и обратного переходов:
прямого и обратного переходов:
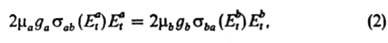
где ma и mb - приведенные массы сталкивающихся частиц, gа и gb- статистич. веса состояний (кратность вырождения). В такой форме Д. р. п. выводится из законов механики на основе обратимости ур-ний движения частиц при изменении знака времени.
В рамках статистич. описания системы как макроскопически наблюдаемого ансамбля частиц рассматриваются распределения частиц по их квантовым состояниям и энергиям до и после соударения. Д. р. п. устанавливает соотношение между константами скорости прямой и обратной р-ций (соотв. каb и кbа). В частности, если имеет место максвелловское распределение частиц по скоростям (или энергиям поступат. движения), определяемое абс. т-рой Т, то
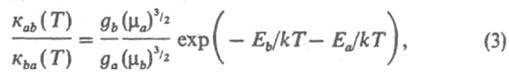
где k - постоянная Больцмана. В результате р-ций в системе устанавливается равновесное максвелл-болъцмановское распределение частиц по энергиям для всех степеней свободы взаимодействующих частиц в процессе тепловой релаксации. После установления такого равновесия отношение макроскопич. констант скорости к и к прямой и обратной р-ций равно константе равновесия К (Т):
к/к = К(Т). (4)
В форме (4) Д. р. п. позволяет в отсутствие хим. равновесия рассчитывать константу скорости прямой р-ции по константе скорости обратной р-ции и известной константе равновесия.
Часто при формулировке Д. р. п. принимают в качестве исходного предположение о равенстве скоростей прямого и обратного процессов при равновесии и получают соотношение типа (3). Однако при таком подходе остается нераскрытым смысл Д. р. п. на динамич. уровне рассмотрения системы. Между тем для неравновесных р-ций, когда нельзя однозначно определить т-ру системы, Д. р. п. может быть использован только в виде соотношения типа (2).
Лит. см. при статьях Динамика элементарного акта
, Неравновесная химическая кинетика
. Е. Е. Никитин.
|

