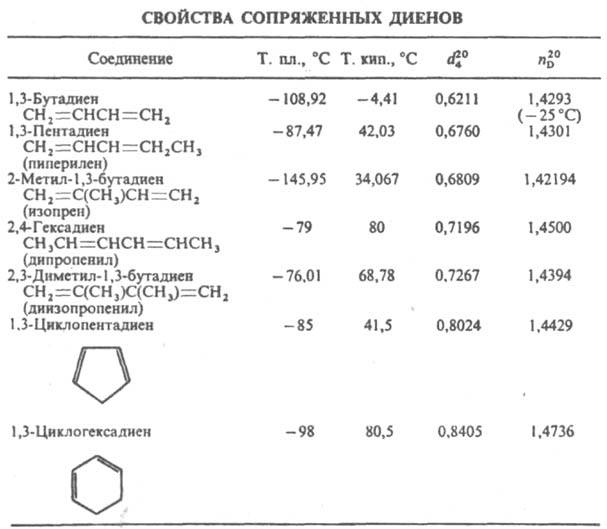
ДИЕНОВЫЕ УГЛЕВОДОРOДЫ
(диены), ненасыщенные углеводороды с двумя двойными связями. Алифатич. диены СnН2n_2 наз. алкадиенами, алициклич. СnН2n_4 - циклоалкадиенами. В статье рассматриваются Д.у. с сопряженными двойными связями [сопряженные диены; см. табл.]. Диены с изолированными двойными связями по хим. св-вам в осн. не отличаются от олефинов
. О соед. с кумулированными двойными связями см. Аллены
.
В Д.у. все четыре атома углерода сопряженной системы имеют sp2-гибридизацию и лежат в одной плоскости. Четыре р-электрона (по одному от каждого атома углерода) комбинируются, образуя четыре p-молекулярные орбитали (две связывающих - занятые и две разрыхляющих - свободные), из к-рых только низшая делокализована по всем атомам углерода.
Частичная делокализация p-электронов обусловливает эффект сопряжения, проявляющийся в уменьшении энергии системы (на 13-17 кДж/моль по сравнению с системой изолированных двойных связей), выравнивании межатомных расстояний: двойные связи несколько длиннее (0,135 нм), а простые - короче (0,146 нм), чем в молекулах без сопряжения (соотв. 0,133 и 0,154 нм), повышении поляризуемости, экзальтации молекулярной рефракции и др. физ. эффектах.
Д. у. существуют в виде двух конформаций, переходящих друг в друга, причем s-транс-форма более устойчива:
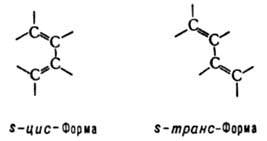
В УФ спектрах Д. у. длинноволновый максимум поглощения сдвинут по сравнению с олефинами в область больших длин волн (батохромный сдвиг) и соответствует для 1,3-бутадиена длине волны 217 нм, изопрена - 220 нм, 2,3-диметил-1,3-бутадиена - 226 нм. Частота валентных колебаний связей углерод-углерод лежит в области 1580-1660 см-1. Сигналы протонов групп СН в спектрах ЯМР1Н находятся в области 5,8-6,4 м.д. (по шкале d).
Наличие единой системы сопряженных связей обусловливает повыш. реакц. способность Д. у. по сравнению с олефинами. Для них характерны р-ции по концам системы сопряженных связей (наряду с р-циями, протекающими по одной из них), сопровождающиеся раскрытием обеих двойных связей и образованием связи между срединными атомами углерода: С=С—С=С : C—С=С—С.
Алифатич. Д. у. полимеризуются и сополимеризуются с разл. виниловыми мономерами с образованием каучуков, каучукоподобных сополимеров, термоэластопластов. Они самопроизвольно димеризуются с образованием, напр., 4-винилциклогексана из бутадиена и дипентена из изопрена. См. также Диеновый синтез
.
Присоединение SO2 к Д. у. приводит к образованию циклич. сульфонов, напр.:
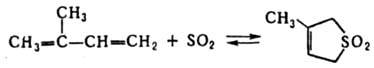
Обратимость р-ции при повыш. т-ре позволяет использовать ее для выделения Д. у. из смеси с близкокипящими олефинами и парафинами.
Присоединение к Д. у. водорода, галогенов и галогеноводородов происходит как по концам системы сопряженных связей (1,4-присоединение), так и по одной из двойных связей [1,2(3,4)-присоединение]. Направление р-ции зависит от природы Д. у. и реагента, катализатора, условий опыта. В этих р-циях термодинамически выгоднее образование продуктов 1,4-присоединения, однако быстрее образуются
продукты 1,2-присоединения (кинетич. контроль р-ции), способные перегруппировываться в продукты 1,4-присоединения. Присоединение галогеноводородов к Д. у. в большинстве случаев протекает в соответствии с правилом Марковникова.
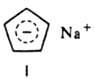
С щелочными металлами 1,3-циклопентадиен образует солеобразные соед., содержащие ароматич. циклопентадиенид-анион, напр., ф-ла I. Д. у. образуют p-комплексы при взаимод. с солями, карбонилами и др. производными Fe, Co, Ni, Сr и др. переходных металлов (см., напр., Ферроцен
).
В присут. кислорода Д. у. образуют пероксиды, инициирующие их полимеризацию.
В пром-сти Д. у. получают каталитич. дегидрированием алканов или алкенов и выделением из продуктов каталитич. или термич. крекинга нефти и нефтепродуктов, проводимого с целью получения этилена. Д. у. могут быть также получены дегидратацией насыщенных диолов, ненасыщенных спиртов, дегидрогалогенированием насыщенных дигалогенидов, частичным гидрированием винилацетиленов, расщеплением 1,4-диаминов и др. Для качеств. и количеств. определения Д. у. используют их р-цию с малеиновым ангидридом, приводящую к получению аддуктов со след. т. пл.: бутадиен 103-104 °С, изопрен 63 64 °С, пиперилен 62 °С, 2,3-диметилбутадиен 78-79 °С.
Д. у. применяют в пром-сти для произ-ва синтетич. каучуков (бутадиен, изопрен, циклопентадиен и др.), смол АБС, высокостирольных сополимеров и термоэластопластов, полиамидных волокон, пластификаторов (бутадиен), лаков и красок, инсектицидов (бутадиен, циклопентадиен), антипиренов, лекарств (циклопентадиен) и др.
Мировые мощности по произ-ву Д. у. составляют ок. 9 млн. т/год (1981).
Д. у. вредно влияют на центр. нервную систему. В газообразном и парообразном виде раздражают слизистые оболочки. При хронич. отравлении вызывают нарушение гемодинамики, дистрофич. изменения паренхиматозных органов, отчетливое раздражение кроветворных органов.
Лит.: Химия алкенов, пер. с англ., Л., 1969; Общая органическая химия, пер. с англ., т. 1, М., 1981, с. 233-81; Терней А., Современная органическая химия, пер. с англ., т. 1, М., 1981, с. 495-535; Фельдблюм В. Ш., Синтез и применение непредельных циклических углеводородов, М., 1982; Губин С. П., Голоунин А. В., Диены и их p-комплексы, Новосиб., 1983. Ф. Е. Куперман.
|

