ЭРБИЙ
(от назв. селения Иттербю,
Ytterby в Швеции; лат. Erbium) Еr, хим. элемент III гр. периодич. системы,
относится к редкоземельным элементам; ат. н. 68, ат. м. 167,26.
В природе 6 стабильных изотопов: 162Еr(0,14%),
1б4Еr(1,61%),
166Еr(33,6%),
167Еr(22,95%),
168Еr(26,8%),
170Еr(14
9%). Конфигурация внеш. электронных оболочек атома 4f l25s25p66s2;
степени окисления +3, редко +1; энергии ионизации при последоват. переходе
от Ег0 к Еr5+ равны соотв. 6,10, 11,93, 22,74, 42,65,
65,1 эВ; электроотрицательность по Полингу 1,24; атомный радиус 0,175 нм,
ионные радиусы Еr3+ (в скобках даны координац. числа) 0,103
(6), 0,109 (7), 0,114 (8), 0,120 (9) нм.
Содержание в земной коре 3,3 x 10-4%
по массе, в морской воде 6 x 10-7 мг/л. Вместе с др. РЗЭ содержится
в минералах ксенотим, эвксенит, монацит, бастнезит, лопарит, ортит и др.
Свойства. Э.- серебристо-белый металл,
имеет одну кристаллич. модификацию структурного типа Mg с гексагон. кристаллич.
решеткой, а = 0,35588 нм, с = 0,55874 нм, z = 2, пространств.
группа Р63/ттс; т. пл. 1522 °С, т. кип. 2510 °С;
плотн. 9,062 г/см3;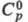 28,12 Дж/(моль х К);
28,12 Дж/(моль х К);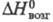 316,5 кДж/ моль;
316,5 кДж/ моль;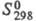 73,18
Дж/(моль х К); давление пара при т-ре плавления 2-8 МПа; температурный
коэф. линейного расширения 1,23 х 10-5 К-1;
73,18
Дж/(моль х К); давление пара при т-ре плавления 2-8 МПа; температурный
коэф. линейного расширения 1,23 х 10-5 К-1;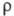 8,5 х 10-7 Ом х м; парамагнетик, магн. восприимчивость +2,63
х 10-7; ферромагнетик ниже 20 К (точка Кюри); антиферромагнетик
ниже 84 К (т-ра Нееля); модуль упругости 74,8 ГПа, модуль сдвига 30,2 ГПа;
коэф. Пуассона 0,238;
8,5 х 10-7 Ом х м; парамагнетик, магн. восприимчивость +2,63
х 10-7; ферромагнетик ниже 20 К (точка Кюри); антиферромагнетик
ниже 84 К (т-ра Нееля); модуль упругости 74,8 ГПа, модуль сдвига 30,2 ГПа;
коэф. Пуассона 0,238;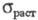 286
МПа. Легко поддается мех. обработке (инертная атмосфера).
286
МПа. Легко поддается мех. обработке (инертная атмосфера).
СВОЙСТВА НЕКОТОРЫХ СОЕДИНЕНИЙ ЭРБИЯ
|
Показатель
|
Еr2O3
|
ErF3
|
ErCl3
|
|
|
Цвет
|
Светло-розовый
|
Светло-розовый
|
Розово-фиолетовый
|
|
|
Сингония
|
Кубич.
|
Моноклинная
|
Ромбет.
|
Тритон.
|
Моноклинная
|
|
|
Параметры ячейки:
а,
нм
|
|
|
|
|
|
|
|
b,нм
|
_
|
0,3470
|
0,6846
|
_
|
1,179
|
|
|
с, нм
|
_
|
0,8555
|
0,4380
|
0,4125
|
0,639
|
|
|
угол, град
|
_
|
100,17
|
_
|
_
|
110,7
|
|
|
Число формульных
единиц в ячейке
|
16
|
6
|
4
|
1
|
4
|
|
|
Пространственная
группа
|
Ia3
|
|
C3m1
|
C3ml
|
С2/m
|
|
|
Т. пл., °С
|
2380
|
1020a
(3 МПа)
|
1117a
|
1146
|
776
|
|
|
Т. кип., °С
|
<3500
|
_
|
_
|
_
|
1500
|
|
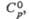
Дж/(моль x К) |
108,5
|
—
|
100,8
|
—
|
—
|
|
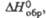
кДж/моль |
-1897,86
|
—
|
-1698
|
29,5б
|
-1000,3
|
|
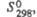
Дж/(моль х К) |
154,3
|
—
|
121,3
|
—
|
155
|
|
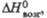
кДж/моль |
—
|
—
|
462,3
|
—
|
280,9
|
|
а Т-ра полиморфного перехода.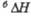 полиморфного перехода.
полиморфного перехода.
На воздухе компактный Э. окисляется медленно,
при нагр. во влажном воздухе неск. быстрее, с минеральными к-тами дает
соли, кипящей водой медленно окисляется, взаимод. с О2, галогенами,
халькогенами, N2 и Н2 при натр., давая соед. Еr(III).
В водных средах Э. существует в виде гидратир. ионов Еr3+ .
С разл. орг. и неорг. лигандами ион Еr(III) образует соед. с координац.
числами от 9 до 15. По хим. св-вам подобен др. лантаноидам(III). Еr(I)
известен только в гидролитически неустойчивых галогенидных кластерах типа
ЕrХ, Еr4Х5, Еr7Х10, Еr6Х7
и т. п., где X = С1, Вr, I, образующихся при взаимод. металлич. Э. с ЕrХ3.
Соед. Еr(III) окрашены в розовый цвет, моногалогениды имеют черную окраску.
Сесквиоксид Еr2О3
(табл.) получают разложением Er(NO3)3, Er2(SO4)3,
Er2(CrO4)3, или др. солей на воздухе обычно
при 800-1000 °С; компонент спец. керамик, люминофоров, лазерных стекол;
временно допустимая концентрация в воздухе 4 мг/м3.
Трифторид ErF3 получают взаимод.
Еr2О3 с HF-газом при 500 °С, термич. разложением
фгораммониевых солей, напр. (NH4)3ErF6, при 400-500
°С в атмосфере Аr, N2; применяют для получения чистого металлич.
Э. металлотермич. способом, в качестве компонента твердых электролитов.
Трихлорид ЕrС13 сильно гигроскопичен; получают взаимод. смеси
С12 и СС14 с оксидом или оксалатом Э. выше 200 °С,
хлорированием Э. и др.; применяют для получения металлоорг. соед. Э. и
металлич. Э. металлотермически или электрохимически.
Получение и применение.
Э. из прир.
смеси РЗЭ выделяют методами экстракции и хроматографии. Дальнейшую очистку,
как правило, проводят хроматографически. Металлич. Э. получают из фторида
и хлорида металлотермически или электрохимически. Выпускают в небольших
масштабах и используют гл. обр. в исследоват. целях как активатор люминесценции
(в т. ч. в твердотельных лазерах), для изготовления магн. материалов (сплавы
с Fe, Co, Ni, Re).
Э. был открыт К. Мосандером при исследовании
эрбиевых концентратов в 1843.
Комплексные соединения Э. характеризуются
чаще всего высокими координац. числами (вплоть до 12), что обусловлено
большими размерами ионов Ег(Ш). Для координац. соед. Э. известны октаэдрические,
пентагонально-бипирамидальные, додеказдрические, икосаздрические, призматические
и др. координац. полиэдры. Хим. связь эрбий-лиганд преим. ионная, эффективные
заряды на атоме Э. в соед. от +2,5 до +2,7, т. е. имеется нек-рый вклад
ковалентной составляющей. Ковалентность увеличивается в ряду РЗЭ по мере
уменьшения размера ионов РЗЭ(III) и для Э. существенно более значима по
сравнению с легкими РЗЭ (лантаном, неодимом).
Комплексные соед. Э. имеют относительно
высокие константы устойчивости, что в особенности характерно для соед.
с полидентатными лигандами. Из неорг. производных наиб. важны гидроксокомплексы
состава [Еr(Н2О)т(ОН)п]3-n,
где n =1-3, т = 2-6, галогенидные комплексы, как катионные
(напр., состава [МХ]2+), так и анионные (напр., [МХ4]-,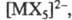
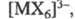 где
X - галоген), нитратные, сульфатные, фосфатные и т. д. Стабильность ацидокомплексов
уменьшается в след, ряду лигандов:
где
X - галоген), нитратные, сульфатные, фосфатные и т. д. Стабильность ацидокомплексов
уменьшается в след, ряду лигандов:
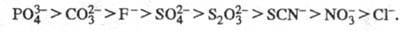
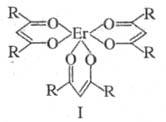
Из комплексов с орг. лигандами перспективны -дикетонаты,
используемые для группового разделения РЗЭ путем фракционной сублимации.
В этих случаях чаще всего применяют дипивалоилметанаты [ф-ла I, R = (СН3)3С]
или ацетилацетонаты (I; R = СН3). Используются, кроме того,
комплексы с дикарбоновыми к-тами (оксалаты, малонаты, сукцинаты и др.),
монокар-боновыми к-тами (вплоть до С30), с аминами, а также
комплексонаты.
-дикетонаты,
используемые для группового разделения РЗЭ путем фракционной сублимации.
В этих случаях чаще всего применяют дипивалоилметанаты [ф-ла I, R = (СН3)3С]
или ацетилацетонаты (I; R = СН3). Используются, кроме того,
комплексы с дикарбоновыми к-тами (оксалаты, малонаты, сукцинаты и др.),
монокар-боновыми к-тами (вплоть до С30), с аминами, а также
комплексонаты.
Последние применяют в технологии
разделения и глубокой очистки РЗЭ методами ионного обмена, экстракции.
Получают комплексные соед. Э. (как и других РЗЭ) взаи-мод. оксидов, гидроксидов,
а также р-ров солей Еr(III) с соответствующими лигандами с послед. кристаллизацией
при упаривании р-ра или высаливании из него. Применяют их в технологии
разделения и очистки собственно РЗЭ, при отделении лантаноидов и актиноидов
и др. Чаще всего эти соед. в технол. практике являются полупродуктами при
получении разнообразных материалов, в т. ч. галогенидных, оксидных и др.
стекол, керамик со св-вами высокотемпературных сверхпроводников и др.
Химия других, по крайней мере тяжелых,
РЗЭ подобна химии комплексных соед. Э.
Л. И. Мартыненко. Ю. М. Киселев,
С. Д. Моисеев.



 28,12 Дж/(моль х К);
28,12 Дж/(моль х К);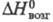 316,5 кДж/ моль;
316,5 кДж/ моль;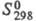 73,18
Дж/(моль х К); давление пара при т-ре плавления 2-8 МПа; температурный
коэф. линейного расширения 1,23 х 10-5 К-1;
73,18
Дж/(моль х К); давление пара при т-ре плавления 2-8 МПа; температурный
коэф. линейного расширения 1,23 х 10-5 К-1;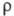 8,5 х 10-7 Ом х м; парамагнетик, магн. восприимчивость +2,63
х 10-7; ферромагнетик ниже 20 К (точка Кюри); антиферромагнетик
ниже 84 К (т-ра Нееля); модуль упругости 74,8 ГПа, модуль сдвига 30,2 ГПа;
коэф. Пуассона 0,238;
8,5 х 10-7 Ом х м; парамагнетик, магн. восприимчивость +2,63
х 10-7; ферромагнетик ниже 20 К (точка Кюри); антиферромагнетик
ниже 84 К (т-ра Нееля); модуль упругости 74,8 ГПа, модуль сдвига 30,2 ГПа;
коэф. Пуассона 0,238;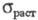 286
МПа. Легко поддается мех. обработке (инертная атмосфера).
286
МПа. Легко поддается мех. обработке (инертная атмосфера).
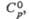 Дж/(моль x К)
Дж/(моль x К)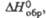 кДж/моль
кДж/моль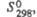 Дж/(моль х К)
Дж/(моль х К)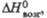 кДж/моль
кДж/моль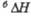 полиморфного перехода.
полиморфного перехода.
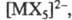
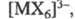 где
X - галоген), нитратные, сульфатные, фосфатные и т. д. Стабильность ацидокомплексов
уменьшается в след, ряду лигандов:
где
X - галоген), нитратные, сульфатные, фосфатные и т. д. Стабильность ацидокомплексов
уменьшается в след, ряду лигандов:
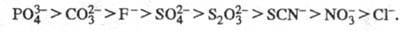
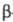 -дикетонаты,
используемые для группового разделения РЗЭ путем фракционной сублимации.
В этих случаях чаще всего применяют дипивалоилметанаты [ф-ла I, R = (СН3)3С]
или ацетилацетонаты (I; R = СН3). Используются, кроме того,
комплексы с дикарбоновыми к-тами (оксалаты, малонаты, сукцинаты и др.),
монокар-боновыми к-тами (вплоть до С30), с аминами, а также
комплексонаты.
-дикетонаты,
используемые для группового разделения РЗЭ путем фракционной сублимации.
В этих случаях чаще всего применяют дипивалоилметанаты [ф-ла I, R = (СН3)3С]
или ацетилацетонаты (I; R = СН3). Используются, кроме того,
комплексы с дикарбоновыми к-тами (оксалаты, малонаты, сукцинаты и др.),
монокар-боновыми к-тами (вплоть до С30), с аминами, а также
комплексонаты.
