ЕНАМИНЫ
, орг. соединения общей ф-лы
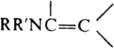
Первичные (R = R = Н) и вторичные (R = Н) Е. могут находиться в таутомерном равновесии с соответствующими иминами, напр.:
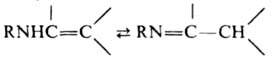
Е. поглощают в УФ области при lмакс 220-235 нм (диенамины - ок. 280 нм); в ИК - при nмакс 1630-1650 см-1, причем при образовании солей (иммоний-катионов) эта полоса сдвигается в высокочастотную область на 20-50 см-1, что отличает Е. от b,g-ненасыщ. аминов.
Е. обычно получают взаимод. альдегидов и кетонов с вторичными аминами (р-ции 1 и 2 соотв.), амидацеталей с соед., имеющими активир. метиленовую группу (3), а также окислением третичных аминов (4) и из N-метиллактамов (5):

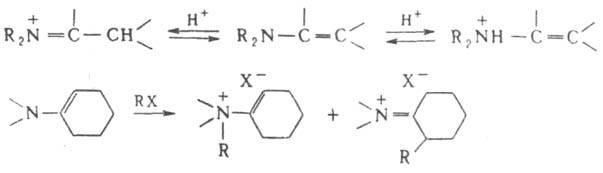
Специфич. р-ции Е. обусловили их широкое использование в орг. синтезе. Протонирование и алкилирование Е. может протекать по атому азота или по b-углеродному атому:
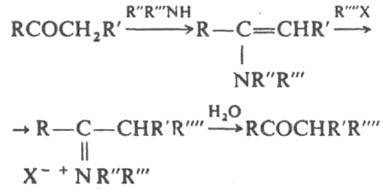
Е. и образующиеся из них соли аммония легко гидролизуются до карбонильных соед., что в сочетании
с b-алкилированием или b-ацилированием Е. позволяет синтезировать замещенные карбонильные соед. (Сторка реакция
):
Е. взаимодействуют с др. электроф. реагентами -a,b-ненасыщ. соед. (эфирами и нитрилами акриловой и кротоновой к-т, винилкетонами, акролеином), изоцианатами, кетеном, напр.:
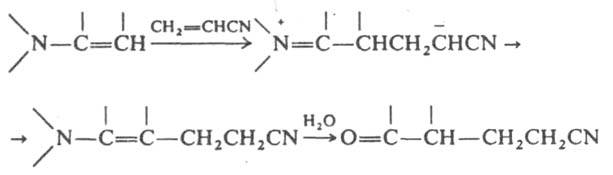
При галогенировании Е. с послед. гидролизом образуются a-галогенальдегиды или a-галогенокетоны. В р-циях с электроф. реагентами чаще всего используют Е., полученные из вторичных циклич. аминов - пирролидина, пиперидина и морфолина.
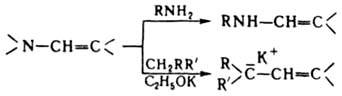
Из р-ций Е. с нуклеоф. реагентами следует отметить их взаимод. с первичными и вторичными аминами (переаминирование) и с соед., имеющими активир. метиленовую группу, напр.:
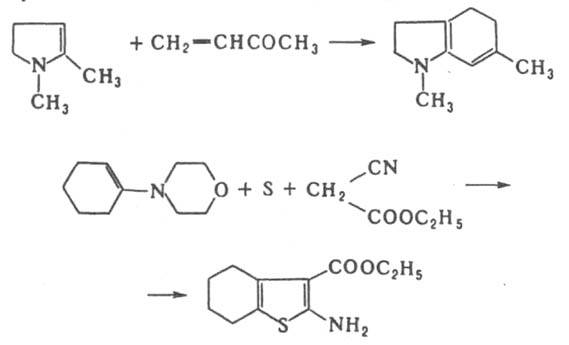
Е. широко используют в синтезе гетероциклич. соед., напр.:
Лит.: Общая органическая химия, пер. с англ., т. 3. М., 1982, с. 91-101,
Граник В. Г . "Успехи химии", 1984. т. 53, в. 4. с. 651-89; Enammcs; synthesis,
structure and reactions, N.Y., 1969 В. Г. Граник.
|

