ФЕРМЕНТАТИВНЫЕ МЕТОДЫ АНАЛИЗА
, основаны на использовании хим. р-ций с участием ферментов
.
О содержании определяемого компонента судят либо по кол-ву конечного продукта
ферментативной р-ции, либо, чаще, по начальной скорости процесса, положенного
в основу методики определения (см. Кинетические методы анализа
). Для
наблюдения за скоростью ферментативной р-ции применяют обычно инструментальные
методы, чаще других - люминесцентные, спектрофотометрич., электрохимические.
Достоинства Ф. м. а.: высокая чувствительность, обусловленная активностью ферментов,
природой индикаторных р-ций (с помощью к-рых определяют в-во) и способами детекции
аналит. сигнала;
высокая селективность и мягкие условия проведения анализа.
Определяемым компонентом
в Ф. м. а. могут быть субстраты (в-ва, превращение к-рых катализирует фермент),
сами ферменты, коферменты
(в-ва, необходимые для осуществления каталитич.
действия фермента) и эффекторы (соед., изменяющие каталитич. активность фермента
- активаторы, ингибиторы). Среди коферментов - НАД и НАДН (соотв. никотинамидадениндинуклеотид
и его восстановленная форма), НАДФ и НАДФН (соотв. никотинамидаденинди-нуклеотидфосфат
и его восстановленная форма), АТФ (аде-нозинтрифосфат) и др.
Предел обнаружения, нижняя
и верхняя границы определяемых содержаний компонентов зависят от кинетич. характеристик
используемой индикаторной ферментативной р-ции и, прежде всего, каталитич. активности
фермента.
Фермент катализирует р-ции,
в к-рых участвуют, как правило, один или два субстрата. В односубстратной р-ции
концентрация субстрата [S]0 пропорциональна скорости процесса v0
только при условии [S]0 Км,
где Км -константа Михаэлиса. Следовательно, верхняя граница
определяемых содержаний лимитируется, как правило, величиной Км.
Предел обнаружения и ниж. граница анализируемых содержаний субстрата определяются
обычно той величиной v0, к-рая м. б. зафиксирована выбранным
инструментальным методом. Чем меньше величина v0 и чем выше
каталитич. константа скорости kкат и концентрация [E]0
фермента, тем ниже предел обнаружения и нижняя граница определяемых содержаний
субстрата. Для двусубстратных р-ций при определении субстрата S1
субстрат S2 берется в насыщенных концентрациях и двусубстратная р-ция
сводится к одно-субстратной.
Км,
где Км -константа Михаэлиса. Следовательно, верхняя граница
определяемых содержаний лимитируется, как правило, величиной Км.
Предел обнаружения и ниж. граница анализируемых содержаний субстрата определяются
обычно той величиной v0, к-рая м. б. зафиксирована выбранным
инструментальным методом. Чем меньше величина v0 и чем выше
каталитич. константа скорости kкат и концентрация [E]0
фермента, тем ниже предел обнаружения и нижняя граница определяемых содержаний
субстрата. Для двусубстратных р-ций при определении субстрата S1
субстрат S2 берется в насыщенных концентрациях и двусубстратная р-ция
сводится к одно-субстратной.
В случае обратимого неконкурентного
инги-бирования фермента ингибиторы I, взаимодействуя с ферментом, образуют каталитически
неактивные комплексы EI. Для ингибиторов этого типа верхняя граница определяемых
содержаний лимитируется величиной KI =[EI] ;
предел [E][I] обнаружения
и нижняя граница определяемых содержаний зависят также и от концентрации фермента.
Такие же зависимости сохраняются и при определении обратимых активаторов ферментов.
В случае необратимого ингибирования
ферментативных р-ций ниж. граница определяемых содержаний ингибитора зависит
от времени ингибирования. Если значение константы скорости этого процесса kин
невелико, относит. уменьшение активности фермента зависит от длительности
процесса ингибирования. При достаточно больших kин временной
зависимостью можно пренебречь, тогда относит. уменьшение активности фермента
пропорционально концентрации ингибитора: 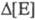 = n[I], где n -
число молекул ингибитора, взаимодействующего с
одной молекулой фермента.
= n[I], где n -
число молекул ингибитора, взаимодействующего с
одной молекулой фермента.
В Ф.м. а. часто используют
системы, состоящие из неск. сопряженных р-ций, катализируемых разл. ферментами.
Так, напр., в случае системы из двух р-ций продукты первой ферментативной р-ции
являются субстратами для второй ферментативной р-ции (индикаторной), что позволяет
повысить чувствительность определения того или иного соед. и при необходимости
изменить способ детекции. Так, напр., для определения глюкозы применяют р-цию
ее окисления кислородом воздуха до глюконовой к-ты и H2O2,
катализируемую глюкозооксидазой. Для контроля за скоростью процесса используют
электрохим. методы, наблюдая за уменьшением кол-ва кислорода в р-ре с помощью
О2-чувствительного электрода Кларка или измеряя рН р-ра. Миним. содержание
глюкозы, к-рое можно определять этими способами детекции, 0,01-0,03 мМ. Применяя
биферментативные сопряженные р-ции для определения глюкозы, контролируют кол-во
образовавшегося H2O2, напр. по р-ции окисления пероксидом
водорода в присут. пероксидазы о-дианизидина (3,3-диметок-сибензидина)
с образованием окрашенного в-ва или люмино-ла с образованием люминесцирующего
соединения. Спектрофотометрич.
или люминесцентный методы контроля позволяют определять содержание глюкозы соотв.
2 мкМ и 20 нМ.
Как правило, чувствительность
определения ферментов, коферментов и эффекторов выше, чем чувствительность определения
субстратов. Напр., возможно определение 0,001 пМ содержания АТФ, 0,1 нМ ионов
Hg2+, Cu2+, Zn2+, 0,1 мкМ тиомочевины и меркаптоэтанола.
Однако ряд субстратов определяют также при очень малых содержаниях, особенно
при хеми- или биолюминесцентной (см. ниже) регистрации аналит. сигнала: 0,1
нМ H2O2, 0,01 нМ мочевины. Чувствительность определения
мн. в-в Ф. м. а. часто более высока, чем чувствительность определения этих же
компонентов любыми др. методами.
Высокая селективность Ф.
м. а. обусловлена образованием фермент-субстратного комплекса в процессе каталитич.
акта, требующим структурного соответствия активного центра фермента и субстрата.
Поэтому большинство ферментов активно только в р-циях с субстратом одного определенного
типа или с группой субстратов, имеющих общие структурные группы. Напр., фермент
глюкозооксидаза катализирует окисление практически только одного вида глюкозы
- 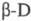 -глюкозу,
к-рую можно определять без разделения сложной смеси моно-и олигосахаридов. В
данном случае проявляется субстратная специфичность фермента.
-глюкозу,
к-рую можно определять без разделения сложной смеси моно-и олигосахаридов. В
данном случае проявляется субстратная специфичность фермента.
Групповую специфичность
можно наблюдать в случае действия альдегидоксидазы в р-циях превращения алифатич.
альдегидов. Значительно менее селективны методы определения эффекторов, т. к.
обычно имеется группа разл. соед., в той или иной степени меняющих каталитич.
активность данного фермента. Однако селективность определения эффекторов м.
б. и очень высокой. Так, очень малые кол-ва ртути (10 пМ) можно определять по
ее ингибирующему действию на пероксидазу хрена на фоне тысячекратных кол-в Bi
и Cd и значительно больших кол-в мн. неорг. и орг. в-в.
Использование иммобилизованных
ферментов. Недостатки Ф. м. а. обусловлены рядом особенностей ферментов:
потерей функциональной активности и стабильности ферментов под воздействием
разл. факторов; высокой стоимостью из-за невозможности многократного использования
растворимых ферментов и трудности их выделения и очистки. Применение иммобилизованных ферментов
расширило возможности Ф. м. а. Более высокая стабильность и возможность
многократного использования иммобилизованных ферментов позволили снизить стоимость
анализов, повысить экспресс-ность, проводить хим. анализ в потоке и автоматизировать
ферментативные методы. Впервые иммобилизованные ферменты в хим. анализе применили
в сер. 60-х гг. 20 в. Для обнаружения фосфорорг. пестицидов в воздухе использовали
холинэстеразу, включенную в крахмальный гель, нанесенный на полиуретановую пластинку.
С помощью глюкозооксидазы или лактатдегидрогеназы, включенных в полиакриламидный
гель, определяли соотв. глюкозу или молочную к-ту.
Помимо единичных иммобилизованных
ферментов, в хим. анализе используют соиммобилизованные ферментные системы,
позволяющие повышать чувствительность и селективность определения. При этом
все чаще применяют иммобилизованные клетки микроорганизмов, содержащие естественный
набор ферментов. Преимущество такой иммобилизации состоит в том, что исключаются
стадии выделения, очистки и иммобилизации ферментов, увеличивается их стабильность.
Иммобилизацию используют не только для ферментов, но и для субстратов, коферментов
и эффекторов.
Предложены разнообразные
реакторы с иммобилизованными ферментами- колонки, трубки, полые нити. Для заполнения
колонок применяют обычно ферменты, ковалентно связанные с аминированным стеклом,
акриловыми полимерами, агарозой, сефарозой, найлоновым порошком, силикагелем
и т. д. Один из лучших носителей для колоночных реакторов - ссфароза, активированная
бромци-аном. На ней успешно иммобилизовали и полиферментные системы. Так, для
определения 2-20 мкМ триптофана анализируемую смесь пропускали через колонку,
содержащую соиммобилизованные
на бромциан-сефаразе триптофаназу и лактатдегидрогеназу.
В трубчатых реакторах фермент
ковалентно иммобилизуется на внутр. пов-сти найлоновой трубки, длина к-рой варьирует
от 1 до 3 м. С помощью таких реакторов, прокачивая через них анализируемый р-р,
определяют, напр., в сыворотке крови мочевину, мочевую к-ту, аминокислоты, глюкозу,
лактозу, мальтозу, пенициллин.
Разработан метод включения
ферментов внутрь полых волокон триацетатцеллюлозы в момент их формования. Фермент
оказывается включенным во внутр. полость, куда могут проникать только низкомол.
субстраты. Эти нити накручивают в виде катушек, заключают в стеклянную оболочку
и через такой бобинный ферментный реактор пропускают анализируемую смесь, напр.,
при определении пенициллина, мочевины или глюкозы.
Скорость пропускания потока
смеси р-ров, содержащих анализируемую пробу и реагенты, через реакторы устанавливают
такой, что после прохождения через ферментный реактор р-ция либо заканчивается
(при анализе по конечному продукту), либо протекает до определенной глубины
(скорость обычно определяют способом фиксированного времени).
Разновидности Ф. м.
а. Среди наиб. чувствительных Ф. м. а. особое место занимают би о люминесцентные
методы (см. Люминесцентный анализ}. Чаще других используют процессы,
катализируемые ферментом люциферазой светляков. Система включает люциферин (ф-ла
1, люциферин светляка), к-рый в присут. АТФ подвергается катализируемому люциферазой
окислению кислородом с образованием люминесцирующего в-ва. Высокий квантовый
выход биолюминесценции, применение полиферментных сопряженных р-ций позволяет
определять нек-рые соед. при концентрации 0,001-0,1 пМ.
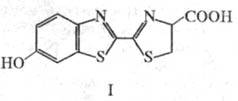
Один из важных Ф.м. а.-
анализ с использованием ферментных электродов, к-рые сочетают высокую селективность
биокатализа и совершенную технику электрохим. методов. В простейшем варианте
расгворимый фермент помещают между двумя полупроницаемыми мембранами; одна отделяет
р-р фермента от электродного датчика, другая - от анализируемого р-ра. Однако
чаще ферменты иммобилизуют, включая их в полимерные или гелевые пленки альбумина,
желатины, агар-агара, коллагена, гидроксида Al или ковалентно присоединяя к
пов-сти стеклянных дисков, полупроницаемых мембран (целлюлозных, поликарбонатных).
Пленки прикрепляют к пов-сти электрода. Часто такую пленку (мембрану) готовят
непосредственно на пов-сти электрода. Субстрат диффундирует через слой, содержащий
фермент, образуя электроактивное в-во, детектируемое при помощи потен-циометрич.
или амперометрич. датчика.
Преимущества потенциометрич.
детектирования - легкость изготовления ферментного электрода и более низкая
его стоимость. Однако время отклика таких электродов весьма значительно. В качестве
электрохим. датчиков при создании ферментных электродов этого типа часто используют
стеклянный рН-электрод, NH+4-специфичный электрод, газовые
электроды для CO2 и NH3. Потенциометрич. ферментные электроды
были предложены для определения аминокислот, мочевины, глюкозы, пенициллина,
нитрит- и нитрат-ионов; применяемые ферменты - оксидазы и декарбоксилазы аминокислот,
уреаза, глюкозооксидаза, нитрит- и нитратредукта-зы и др.
Амперометрич. ферментные
электроды обычно применяют в случае ферментативных р-ций, протекающих с выделением
или потреблением O2 или H2O2. Используют при
этом O2- или H2O2-чувствительные электроды.
Амперометрич. детекторы отличаются от потенциометрических более широким диапазоном
линейности. В амперометрич. ферментных датчиках применяют чаще всего ФАД(флавинадениндинуклеотид)-за-висимые
оксидазы для определения глюкозы, холестерина, аминокислот.
В ферментных электродах
м. б. использованы не только одноферментные и полиферментные системы, но и клетки
микроорганизмов ("бактериальные" электроды). Созданы ферментные
электроды с ферментным реактором. В таком электроде иммобилизованный (напр.,
на стеклянных шариках) фермент помещен в небольшой реактор, через к-рый пропускают
анализируемую пробу. Продукты р-ции - электроактивные в-ва, их детектируют с
помощью проточных измерительных электродов. Ферментные электроды такого типа
применяют для определения мочевины и аминокислот.
Ферментные электроды представляют
собой биосенсоры (см. Сенсоры химические
), к-рые позволяют быстро и селективно
проводить определение целого ряда компонентов в сложных по составу объектах.
На основе использования
ферментов созданы разл. экспресс-тесты. Многие из них чрезвычайно просты. Напр.,
тест-устройство для определения токсичных фосфорсодержащих пестицидов в продуктах
питания представляет собой бумажную полоску, один конец к-рой пропитан р-ром
хро-могенного субстрата, а второй содержит иммобилизованную холинэстеразу. При
анализе концы полоски совмещают и обмакивают в воду, выжатый из фруктов или
овощей сок и т. д. Появление окраски бумажки свидетельствует об отсутствии пестицидов
в пробе. T. к. пестициды в больших, чем ПДК, кол-вах ингибируют холинэстеразу,
то отсутствие окраски свидетельствует о превышении ПДК пестицидов. Аналогичные
бумажные тесты предложены для определения глюкозы в моче и крови, ртути в воде
и т. д.
Широкое распространение
получают иммунофер-ментные методы- разновидность иммунных методов анализа (радиоактивная
или флуоресцентная метка заменяется ферментом). Их используют для определения
иммуногло-булинов, гормонов, стероидов, лек. ср-в, пестицидов и др. Эти методы
обладают исключительно высокой чувствительностью и селективностью.
Для повышения воспроизводимости,
экспрессности и производительности в Ф. м. а. применяют автоматич. анализаторы
разного типа (см. Автоматизированный анализ
). Катали-тич. р-ции с участием
растворимых и иммобилизованных ферментов, а также ферментных реакторов все чаще
используют в проточно-инжекционном анализе.
Ф. м. а. применяют в хим.
анализе, по сравнению с др. методами, недостаточно. Из более чем 1800 полученных
ферментов используют ок. 50; наиб. часто - глюкозооксида-зу, уреазу, уриказу,
люциферазу, пероксидазу, алкогольдегид-рогеназу, холинэстеразу, лактатдегидрогеназу,
разл. аминоок-сидазы. Ф. м. а. позволяют определять селективно, а в отдельных
случаях специфично такие биологически активные субстраты, как глюкоза, мочевина
и мочевая к-та, разл. аминокислоты, липиды, холестерин, антибиотики, этанол,
H2O2, NO-2 и NO-3
и мн. другие. Разработаны чрезвычайно чувствительные методы определения мн.
ферментов (перок-сидазы в крови, креатинфосфокиназы в крови при диагностике
инсульта и инфаркта миокарда и др.) и коферментов (НАД, флавинмононуклеотид,
АТФ и т.д.). Предложены методики чувствительного определения большого числа
эффекторов ферментов (фосфорсодержащие пестициды, ионы Hg, Cu, Zn и др.). Чрезвычайно
чувствительны и селективны методы определения нек-рых ионов металлов (Zn, Cu)
и анионов (CN-) на основе реактивации апоферментов. Цинк, напр.,
определяют практически специфически и в пикограммовых кол-вах по реактивации
иммобилизованной пируватоксидазы, дезактивированной рядом комплексонов.
Осн. области применения
Ф. м. а.- клинич. медицина и биохимия. С помощью ферментов в крови, моче, тканях
и др. биол. объектах определяют малые кол-ва физиологически активных в-в, метаболитов,
ферментов, мутагенов, канцерогенов, лек. препаратов. Высокочувствительный и
специфический биолюминесцентный метод определения АТФ позволяет разрабатывать
методики измерения кол-ва клеток микроорганизмов, обнаружения микробных заражений,
определения антибиотиков в биол. тканях и жидкостях по степени инги-бирования
микробных клеток. Поскольку содержание АТФ пропорционально кол-ву клеток или
биомассы, то эти методики чрезвычайно чувствительны и предел обнаружения может
достигать 100 клеток. Ферментативные методы используют также в пищ. и фармакологич.
пром-сти, при контроле загрязнений окружающей среды. Так, напр., разработаны
и применяются ферментативные методы определения фосфорсодержащих пестицидов,
фенолов, аминов, ионов тяжелых металлов в природных и сточных водах.
Лит.: Долманова
И. Ф., Угарова Н.Н., "Ж. аналит. химии", 1980, т. 35, в. 8, с. 1597-1639;
Кулис Ю.Ю., Аналитические системы на основе иммобилизованных ферментов, Вильнюс,
1981; Угарова H. H., Б r о в -ко Л. Ю., Биолюминесценция и биолюминесцентный
анализ, M., 1981; Bioana-lytical applications of enzymes, ed. by C. Suelter,
в сб.: Methods of biochemical analyses, N. Y., 1992. И. Ф. Долманова.
|

