ФОРМАТИРОВАНИЕ
, введение
формильной группы CHO в молекулу орг. (реже неорганических) соединений. В зависимости
от того, к какому атому в субстрате присоединяется формильная группа, различают
С-, N-, О- и S-F. С-Ф.- один из важнейших методов получения альдегидов.
Ф. гетероато-мов применяют для защиты групп NH2, ОН, SH; для получения
формамида, эфиров муравьиной и тиомуравьиной к-т; для проведения р-ций циклизации.
Формальными синтонами (см. Органический синтез
)в р-циях Ф. могут быть формил-катион, формил-радикал
и формил-анион. Большинство р-ций Ф. протекает с участием формил-катиона ,
к-рый атакует электроноизбыточные положения субстрата (электроф. Ф.):
,
к-рый атакует электроноизбыточные положения субстрата (электроф. Ф.):

В качестве электроф. формилирующих
реагентов (синтетич. эквивалентов формил-катиона) применяют соед., в к-рых формильная
группа присутствует либо в явном виде, напр, муравьиная к-та, формилфторид,
этилформиат, смешанный ангидрид муравьиной и уксусной к-т, ДМФА и др., либо
в маскированном, напр. ортомуравьиный эфир, синильная к-та, гексаметилентетрамин,
1,3,5-триазин. В последнем случае формильная группа образуется в результате
гидролитич., восстановит, и прочих превращений, к-рым подвергаются промежут.
продукты присоединения формилирующего агента к субстрату. Так, Ф. ароматич.
соед. может быть осуществлено действием N, N-дизамещ. производных формамида
и POCl3 (Вильсмайера реакция
)либо действием смеси СО и HCl
(Гаттермана-Коха реакция
); для Ф. фенолов и их эфиров используют HCN
и HCl в присут. к-т Льюиса (Гаттермана синтез
), нагревание с гексаметилентетрамином
и H3BO3 (Даффа реакция
), взаимод. фенолов с CHCl3
в щелочной среде (Раймера-Тимана реакция
). В качестве формилирующих агентов
(для ароматич. углеводородов, фенолов и их эфиров, азулена, гетероциклич. соед.)
применяют также ди-хлорметилалкиловые эфиры Cl2CHOR; р-цию проводят
в присут. AlCl3 или других к-т Льюиса (TiCl4, SnCl4)
с послед. гидролизом (р - ция Рихе), напр.:
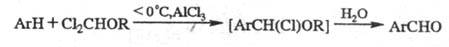
В нек-рых случаях формилируют
не сам субстрат, а его металлоорг. производное; это позволяет вводить альдегидную
группу и в неактивир. (для электроф. замещения) положение молекулы, напр.:
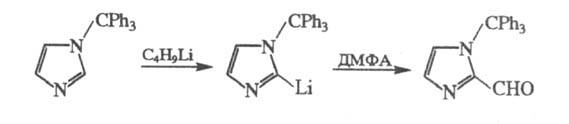
Вместо ДМФА в подобных
р-циях можно использовать N-ме-тилформамид, N-формилпиперидин, N-формилморфолин
и др. Формильная группа может замещать остаток MgX в реактивах Гриньяра (р-ция
Буво): HCONRR: +
RMgBr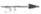 RCHO.
В р-цию вступают только замещенные формамиды.
RCHO.
В р-цию вступают только замещенные формамиды.
Ф. электронодефицитных
соединений проводят в условиях свободно-радикального процесса. Так, лепидин
(4-метилхи-нолин) формилируется триоксаном в присут. CF3COOH или
mpem-бутилпероксида и Fe2+ в положение 2 с выходом 61%. В
ходе р-ции генерируемый триоксанильный радикал (синте-тич. эквивалент формил-радикала)
благодаря нуклеоф. характеру атакует атом С-2 в катионе лепидиния:
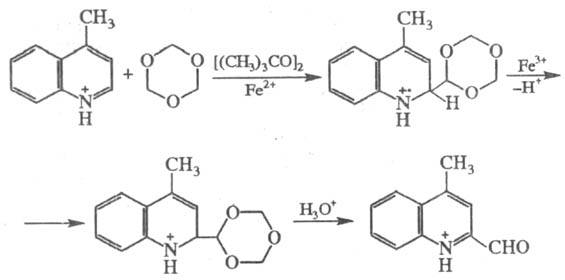
Нуклеоф. формилирующим
агентом может служить анион 1,3-дитиана (синтетич. эквивалент формил-аниона),
напр.:
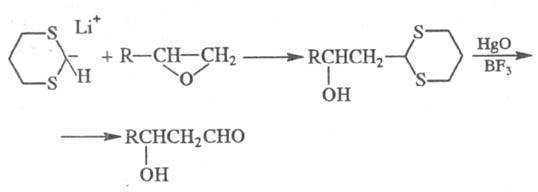
Примером Ф. неорг. соед.
служит р-ция динатрийтетракар-бонилжелеза с N-формилимидазолом в присут. триалкилбо-ратов
в среде ТГФ; в результате один атом Na замещается на формильную группу:
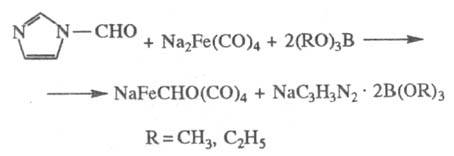
Ф. имеет важное биохим.
значение, напр. в биосинтезе имидазолов, пуринов и пиримидинов. В живых организмах
переносчиком формильных групп служит тетрагидрофолие-вая к-та (см. Фолацин
).
См. также Гидроформилирование
.
Лит.: Бюлер К.,
Пирсон Д., Органические синтезы, пер. с англ., ч. 2, M., 1973, с. 49, 77; Мищенко
Г.Л., Вацуро К. В., Синтетические методы органической химии, M., 1982, с. 372;
Общая органическая химия, пер. с англ., т. 2, M., 1982, с. 488; Olah G. А. [а.
о.], "Chem. Rev.", 1987, v. 87, Ns 4, p. 671-86. А Ф. Пожарский.
|

