ФОСФАЗОСОЕДИНЕНИЯ
(иминофосфораны,
фосфазе-ны), соед. общей ф-лы RN = PR3, где R = H, Alk, Ar, Ac,
Hal и др., R = Alk, Ar, Hal, OR:, NR2: и др.
Ф. подразделяют на группы
в зависимости от строения R [напр., R = R:SO2 - фосфазосульфоны,
R = R:C(O) - фосф-азокарбацилы, R = H - фосфазогидриды]. Полимерные соед.,
содержащие в макромолекулах группу R2P = N — , наз. поли-фосфазены,
циклич. Ф. общей ф-лы ( — R2P = N — )n -циклофосфазены
(и - обычно 3), Ф. типа R2C = Nn --N= PR3
- фосфазины. Назв. Ф. включает назв. радикалов у атомов P и N, к-рые являются
префиксами к слову "фосфоран" или используются в сочетании с корнем
"фос-фазо" [напр., Ph3P = NCH3 - трифенил(метилимино)фосфо-ран,
трифенилфосфазометан].
Ф- жидкости или кристаллич.
соед.; многие перегоняются в вакууме и имеют четкие т-ры плавления; раств. в
орг. р-рителях. Конфигурация молекул Ф.- тетраэдрическая с атомом P в центре.
Атому N свойственна преимущественно
sр2-гибридизация; степень двоесвязанности атомов P и N возрастает
с увеличением электроотрицательности заместителя у атома N. Ди-польные моменты
у Ф. от 6,00-10-30 до 3,04 ·10-29 Кл·м и достигают наиб.
высоких значений среди известных орг. соед. фосфора; направление диполя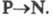
В ИК спектрах полосы поглощения
связи P = N находятся в области 1150-1370 см -1. В спектрах ЯМР 31P
хим. сдвиги от -50 до +140 м. д.
Ф. с заместителями (прежде
всего, у атома N), обладающими небольшой электроотрицательностью, проявляют
основные св-ва: протонируются к-тами и алкилируются алкилгало-генидами по атому
N, образуют комплексы с к-тами Льюиса и галогенидами металлов (Cu, Со, Ni, Hg
и др.).
Термич. устойчивость Ф.
изменяется в широких пределах. Так, напр., CH3C(O)N = PCl3
разлагается при 0 0C, а CCl3C(O)N = PCl3 перегоняется
без разложения (т. кип. 255-259 0C); эфиры ROC(O)N = PR2Hal
сравнительно легко отщепляют RHal (для R = Alk при ~ 20 0C) и образуют
изоцианаты R2P(O)NCO.
При повышенных т-рах Ф.
типа RN = PNHR испытывают равновесные превращения по схеме:
RN = P(NHR)R:2
 RN =
P(NHR)R2: RC(O)N = P(NHR)R:2
RN =
P(NHR)R2: RC(O)N = P(NHR)R:2 RN
= P[NHC(O)R]R:2
RN
= P[NHC(O)R]R:2
Ф. общих ф-л R2(RO)P
= NR: и R2(RO)P = NP(O)R:2 перегруппировываются
соотв. в OPR2NRR: и OP(R)2N = = P(R:)2OR.
Ф. типа YN = PR3
(Y = H, Alk) гидролизуются уже на воздухе; при Y = Ar, RC(O), ROC(O) и R =
Hal- лишь в кислых или щелочных средах, напр.:
RC(O)N = P(OR)3
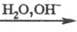 ROH
+ RC(O)NHP(O)(OR)2
ROH
+ RC(O)NHP(O)(OR)2
Ф. типа Hal3P
= NAr легко димеризуются образуя ц и к -лодифосфазаны, напр.:
Фосфазогидрвды R3P=NH
реагируют с металлоорг. соед. RnM (M - металл I-III гр. периодич. системы,
n = 1-3) с образованием Ф. типа R3P=NMRn-1; при
действии RLi на фосфазоалкилы или фосфазоарилы образуются пентакарбо-фосфораны
R5P.
Большинство Ф. активно
взаимод. с карбонильными и тиокарбонильными соед., напр.:
R3P = NR + R:2C(O) R3P(O) +R:2C = NR
R3P(O) +R:2C = NR
Фосфорильные соед. образуются
также в р-циях Ф. с изоцианатами, кетенами, SO2 и NOCl.
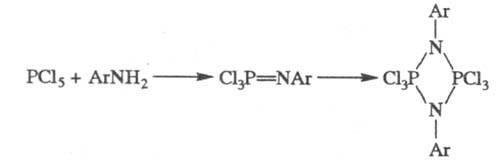
В р-циях Ф. с нитрилами
образуются новые типы Ф., а с ацетиленами - алкилиденфосфораны, напр.:
Циклофосфазены легко вступают
в р-ции замещения (в т. ч. по Фриделю-Крафтсу), напр.:
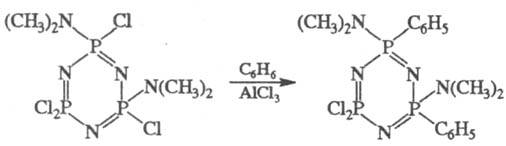
Для получения Ф. наиб,
часто используют два способа:
1) Взаимод. дигалогенфосфоранов
с амидами разл. к-т (т. наз. фосфазореакция; см. Кирсанова реакция
)или
с арил-либо силиламинами:
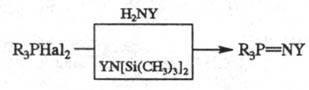
R=Alk, Ar, OR, NR2;
Hal=Cl, Br; Y=RC(O), RSO2, FSO2, PF2 и др.
2) Окислит, иминирование
соед. трехкоординац. P:

Возможно также применение
иминирующих агентов др. структуры и внутримол. окислит. иминирование:
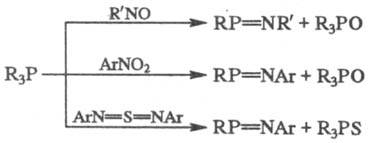
Иногда для получения Ф.
используют соед. 4-координац. P - алкилиденфосфораны, фосфиноксиды и фосфинсульфи-ды,
напр.:
Ph3PO 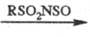 Ph3P=NSO2R
Ph3P=NSO2R
R3P=CHR  R3P=NC(R:)=CHR Фосфазины получают по схеме:
R3P=NC(R:)=CHR Фосфазины получают по схеме:
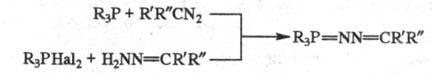
Циклофосфазены обычно получают
взаимод. линейных Ф., имеющих концевые группы NH2, с галогенфосфоранами,
напр.:
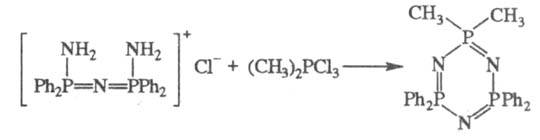
Среди Ф. имеются соед.
с инсектицидной активностью, нек-рые Ф. (в частности, содержащие группы — N
= P-F и—N = POC6H4NO2-n) обладают общеядовитым
действием по отношению к теплокровным.
Ф. применяют для синтеза
полифосфазенов и в препара-тивной практике (напр., в синтезе нитрилов сложного
строения, алкилиденфосфоранов, циклофосфазанов и др.).
Лит.: Фосфазосоединения,
К., 1965; Кирсанов А.В., в кн.: Химия и применение фосфорорпшическнх соединений.
Труды Ш конференции, M., 1972, с. 75-88; Олкок Г., Фосфоразотастые соединения,
пер. с англ., M., 1976; Коrбридж Д., Фосфор, пер. с англ., M., 1982, с.
309-16.
Г. И. Дрозд.
|

