ФОСФИНЫ
. 1) Неорганические
фосфины (гидриды фосфора, фосфиды водорода) - соед. фосфора с водородом.
Ф о с ф и н (фосфористый водород) PH3 - бесцв. газ с резким запахом
гнилой рыбы; конфигурация молекулы - тригон. пирамида; т. пл. -133,8 0C,
т. кип. -87,4 0C; плотн. 1,529 г/л, относительно воздуха 1,2; C0p
3,93 Дж/(моль· К); 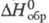 5,4 кДж/моль; S0298 209,93 Дж/(моль· К); образует кристаллы
с гранецентрир. кубич. решеткой. Раств. в бензоле, диэти-ловом эфире, CS2.
Умеренно раств. в воде, причем, в р-ре устанавливается равновесие:
5,4 кДж/моль; S0298 209,93 Дж/(моль· К); образует кристаллы
с гранецентрир. кубич. решеткой. Раств. в бензоле, диэти-ловом эфире, CS2.
Умеренно раств. в воде, причем, в р-ре устанавливается равновесие: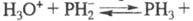
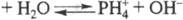 . Поскольку значения рКа и рКb практически
равны, водные р-ры PH3 можно рассматривать как слабый идеальный амфолит.
Электронодонорные св-ва PH3 выражены гораздо слабее, чем у NH3,
однако они резко увеличиваются при замене атомов H на орг. радикалы (см. ниже).
. Поскольку значения рКа и рКb практически
равны, водные р-ры PH3 можно рассматривать как слабый идеальный амфолит.
Электронодонорные св-ва PH3 выражены гораздо слабее, чем у NH3,
однако они резко увеличиваются при замене атомов H на орг. радикалы (см. ниже).
Ион фосфония PH+4
малоустойчив. Самая устойчивая соль фосфония (в твердом состоянии) - иодид PH4I.
Водой и щелочными р-рами соли фосфония разлагаются с выделением PH3.
PH3 и соли фосфония
- сильные восстановители. При нагр. PH3 разлагается, на воздухе выше
100 0C воспламеняется, в прйсут. небольших кол-в P2H4
самовозгорается, в смеси с O2 взрывается. В щелочных р-рах окислит.-восстановит.
потенциал PH3 -1,12 В (PH3 + 5OH- - 4е H2PO-2 + 3H2O). PH3 восстанавливает
ионы мн. металлов из р-ров их солей.
H2PO-2 + 3H2O). PH3 восстанавливает
ионы мн. металлов из р-ров их солей.
Получают PH3
взаимод. фосфидов (напр., Cu3P2) с водой или к-той; наряду
с PH3 образуются небольшие кол-ва P2H4. Его
синтезируют также р-цией белого P с р-ром щелочи при нагр., взаимод. KOH с PH4I
в водном р-ре. PH3 образуется при получении белого и красного P;
при действии к-т на фосфиды металлов (напр., при травлении сталей, содержащих
заметную примесь P);
при использовании цианамида Ca, загрязненного Ca3(PO4)2,
и ацетилена, полученного из фосфорсодержащего карбида (содержание PH3
в C2H2 иногда достигает 0,02-0,06%); при применении вместо
извести карбидных отходов от получения ацетилена. Используют PH3
для синтеза фосфорорг. соед., для получения фосфора особой чистоты (2PH3+
2PCl3 4Р + 6НС1). Токсичен, действует преим. на нервную систему, нарушает обмен в-в
и др.; минимальная предостерегающая концентрация 0,00014- 0,00028% (по объему),
запах ощущается при 0,002- 0,004 мг/л, при концентрации 0,01 мг/л многочасовое
воздействие может привести к смерти.
4Р + 6НС1). Токсичен, действует преим. на нервную систему, нарушает обмен в-в
и др.; минимальная предостерегающая концентрация 0,00014- 0,00028% (по объему),
запах ощущается при 0,002- 0,004 мг/л, при концентрации 0,01 мг/л многочасовое
воздействие может привести к смерти.
Дифосфин P2H4
- бесцв. летучая жидкость; по конфигурации молекулы подобен гидразину, но не
обладает основными св-вами, не реагирует с к-тами. Сильный восстановитель, на
воздухе самовоспламеняется, при нагр. и хранении на свету разлагается. В продуктах
распада присутствуют P, PH3 и аморфное в-во желтого цвета (твердый
фосфористый водород), представляющее собой низшие гидриды фосфора PxHy.,
где x > у, напр. P2H, P5H2,
P9H2, P12H6. Это в-во раств. только
в дифосфине и расплавленном P, при обычных условиях устойчиво; восстановитель.
Лит.: Осадченко
И.М., Томилов А.П., "Успехи химии", 1969, т. 38, в. 6, с. 1089-107.
См. также лит. при ст. Фосфора галогениды
.
Я. А. Угай
.
2) Органические фосфины
- соед. общей ф-лы RnPH3-n, где R -
орг. радикал; n = 1-3.
Различают первичные (n
= 1), вторичные (n = 2) и третичные (п = 3) Ф. Известны дифосфины
(напр., R2PPR2), трифос-фины и циклич. фосфины с неск.
атомами P в цикле, а также с атомом P и др. гетероатомом в цикле (о последних
см. в ст. Фосфорсодержащие гетероциклы
).
За исключением неск. низших
представителей [напр., CH3PH2, 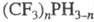 ] Ф.- жидкости или кристаллич. в-ва с характерным неприятным запахом; хорошо
раств. в орг. р-рителях, ограниченно в воде. Ф.- низкополярные в-ва [напр.,
] Ф.- жидкости или кристаллич. в-ва с характерным неприятным запахом; хорошо
раств. в орг. р-рителях, ограниченно в воде. Ф.- низкополярные в-ва [напр.,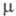 (Кл-м)
для CH3PH2 4· 10-30, для (C2H5)3P
6,14· 10-30, для Ph3P 4,87 · 10-30]. Конфигурация
молекул тригонально-пи-рамидальная.
(Кл-м)
для CH3PH2 4· 10-30, для (C2H5)3P
6,14· 10-30, для Ph3P 4,87 · 10-30]. Конфигурация
молекул тригонально-пи-рамидальная.
Хим. сдвиги в спектре ЯМР
31P относительно 85%-ной H3PO4 (в м. д.) колеблются
в пределах: для первичных Ф.- от -110 до -163, для вторичных - от -40 до -90,
для третичных -от -166 до +7. Константы спин-спинового взаимод. (в Гц) в пределах
162-210 (первичные Ф.) и 178-240 (вторичные Ф.). В ИК спектрах первичных и вторичных
Ф. полосы поглощения для связи Р — Н в области 2270-2290 см -1.
Ф. легко окисляются на
воздухе, наиб, летучие - самовоспламеняются. Основность Ф. значительно зависит
от заместителей у атома P; рКа нек-рых Ф. в CH3NO2:
изо
-С4Н9РН2 0,02; (изо
-С4Н9)2РН
4,11; (изо
-С4Н9)3Р 7,97; (СН3)3Р
8,65; Ph3P 2,73. Обычно основность уменьшается в ряду: R3P
> > R2PH > RPH2 (соотв. уменьшается устойчивость
солей Ф. с к-тами). Ф. образуют комплексы с к-тами Льюиса, галоге-нидами и карбонилами
переходных металлов, а также с Ni, Pd и Pt; известны многочисленные комплексы
третичных Ф. с ненасыщ. соед. (CS2, фторолефинами, хинонами и др.).
Ф. присоединяют О и S,
образуя соотв. фосфиноксиды или фосфинсульфиды; источниками О и S могут служить
перок-сиды, R3ЭO (Э = N, As), эпоксиды, сульфоксиды, диоргано-полисульфиды,
эписульфиды. При действии на Ф. галогенов образуются галогенфосфины
или
галогенфосфораны, напр.:
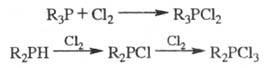
Обработка Ф. щелочными
металлами приводит к органил-фосфидам 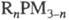 (п = 1, 2), действие RHal (Hal = Br, I) - к фосфониевым солям. С карбенами
или CHal4 (Hal = Cl, Br) третичные Ф. образуют фосфиналкилены (илиды),
напр. R3P = CBr2; с азидами - фосфазосоед., напр. R3P
= NAr; с диазоалканами - фосфиназины, напр. R3P = NN = CH2,
или фосфиналкилены. Первичные и вторичные Ф. легко присоединяются
к альдегидам и кетонам с образованием a-гидро-ксиалкилфосфинов.
(п = 1, 2), действие RHal (Hal = Br, I) - к фосфониевым солям. С карбенами
или CHal4 (Hal = Cl, Br) третичные Ф. образуют фосфиналкилены (илиды),
напр. R3P = CBr2; с азидами - фосфазосоед., напр. R3P
= NAr; с диазоалканами - фосфиназины, напр. R3P = NN = CH2,
или фосфиналкилены. Первичные и вторичные Ф. легко присоединяются
к альдегидам и кетонам с образованием a-гидро-ксиалкилфосфинов.
Ф. обычно получают восстановлением
галогенангидридов к-т 5- или 3-валентного P, фосфиноксидов либо фосфинсупь-фидов,
напр.:
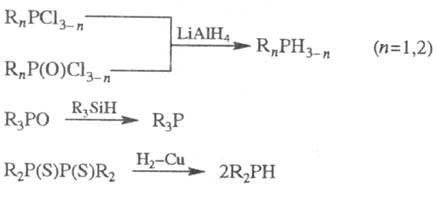
Препаративное значение
имеет также алкилирование фосфидов щелочных металлов в жидком NH3
или инертных р-рителях:
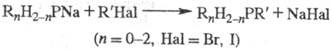
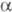 -Гидроксиалкилфосфины (преим. третичные) получают взаимод. фосфинов R3PH3_n
(n = 0-2) с альдегидами или кетонами, напр.:
-Гидроксиалкилфосфины (преим. третичные) получают взаимод. фосфинов R3PH3_n
(n = 0-2) с альдегидами или кетонами, напр.:
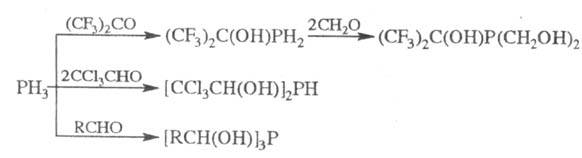
В лаб. практике третичные
Ф. часто получают действием металлоорг. соед. RM (M = MgHal, Li, PbR3,
SnR3, AlR2) на галогенангидриды или эфиры к-т 3-валентного
P, а также присоединением фосфинов RnPH3-n (п = 0-2) к олефинам.
Ацилфосфины, а также Ф.
с перфторалкильными радикалами (RF) можно синтезировать по р-циям:
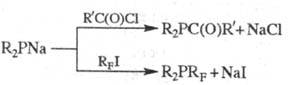
Ф. типа (RF)3P
получают алкилированием красного P или его смеси с P2I4
перфториодалканами (200-280 0C, проточная система или автоклав с
мешалкой). Действием RFI на циклич. полифосфины (RP)n
получают Ф. типа RP(RF)2.
Ф.- реагенты в орг. синтезе
(восстановители, инициаторы полимеризации, исходные при получении фосфорсодержащих
полимеров и т.д.), добавки к смазочным маслам, анти-пирены.
Низшие члены Ф. жирного
ряда ядовиты и по характеру действия на организм напоминают PH3.
См. также Триметилолфосфин
,
Трифенилфосфин
.
Лит.: Петров К.А.,
Паршина В.А., "Успехи химии", 1968, т. 37, в. 1, с. 1218-42; Пурдела
Д., Вылчану Р.,Химия органических соединений фосфора, пер. с рум., M., 1972,
с. 68-162; Общая органическая химия, пер. с англ., т. 4, M., 1983, с. 602-38;
Mark V. [а. о.], "Topics Phosph. Chem.", 1967, № 5, p. 227. Г.
И. Дрозд.
|

