ЭТИЛЕНДИАМИНТЕТРАУКСУСНАЯ КИСЛОТА
[этилен-бис-(иминодиуксусная
к-та), этилендинитрилотетрауксусная к-та, ЭДТА, комплексон П, хелатон П]
(HOOCCH2)2NCH2CH2N(CH2COOH)2,
мол. м. 292,252; бесцв. кристаллы, термически устойчивы до 180 °С, плохо
раств. в воде, раств. в р-рах щелочей, не раств. в орг. р-рителях (за исключением
формамида).
Четырехосновная аминокислота: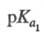 2,00,
2,00,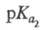 2,66,
2,66,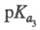 6,17,
6,17,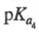 10,24
(20 °С); р/ 1,7; в твердом виде и в р-ре имеет структуру цвиттер-иона.
Образует устойчивые комплексы с катионами разл. элементов; при этом выступает
в качестве пента- или гексадентатного лиганда (см. Хелаты). Комплексы
устойчивы в водных средах, большинство из них раств. в воде.
10,24
(20 °С); р/ 1,7; в твердом виде и в р-ре имеет структуру цвиттер-иона.
Образует устойчивые комплексы с катионами разл. элементов; при этом выступает
в качестве пента- или гексадентатного лиганда (см. Хелаты). Комплексы
устойчивы в водных средах, большинство из них раств. в воде.
В зависимости от значения рН Э. к. образует
простые [ML]4-m, гидридные [MHnL]4-m-nи
гидроксикомплексы [M(OH)nL]4-m-n (L
- Э. к.; т - степень окисления металла М; n=1,2).
Наименее устойчивы комплексы с щелочными
металлами (напр.,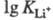 = 2,79
= 2,79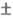 0,06,
здесь и далее К - константа устойчивости 0,1 н. р-ра комплекса при
20 °С). Высокой устойчивостью обладают простые комплексы с катионами щел.-зем.
металлов (напр.,
0,06,
здесь и далее К - константа устойчивости 0,1 н. р-ра комплекса при
20 °С). Высокой устойчивостью обладают простые комплексы с катионами щел.-зем.
металлов (напр.,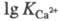 =
10,7); непереходных металлов III группы (напр.,
=
10,7); непереходных металлов III группы (напр.,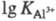 =
16,3); 3d-элементов в степени окисления +2 (напр.,
=
16,3); 3d-элементов в степени окисления +2 (напр.,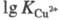 =
18,80), при этом порядок устойчивости комплексов изменяется в следующем
ряду:
=
18,80), при этом порядок устойчивости комплексов изменяется в следующем
ряду:
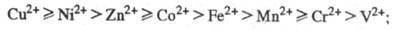
3 d-элементов в степени окисления
+3, устойчивость последних более чем на 10 порядков выше, чем соответствующих
двухзарядных катионов (напр.,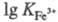 =25,1;
=25,1;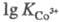 =40,7);
4f- и 5f-элементов (напр.,
=40,7);
4f- и 5f-элементов (напр.,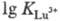 =
19,8;
=
19,8;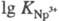 =24,6).
Существуют комплексы состава металл : лиганд (1:2), (2:1) и др., а также
гетеролигандные комплексы.
=24,6).
Существуют комплексы состава металл : лиганд (1:2), (2:1) и др., а также
гетеролигандные комплексы.
Получают Э. к. взаимод. этилендиамина
с монохлоруксусной к-той в щелочной среде либо цианметилированием этилендиамина
с послед. гидролизом полученного нитрила (см. Штреккера реакции
).
Применяют Э. к. в осн. в виде дигидрата
динатриевой соли (комплексон III, трилон Б, хелатон III) - бесцв. кристаллы,
раств. в воде, не раств. в орг. р-рителях.
Э. к. используют в аналит. химии в качестве
титранта в комплексонометрии и маскирующего агента, для разделения и выделения
ионов металлов, для извлечения и очистки РЗЭ, очистки пов-стей металлов
перед гальванопластикой, для растворения разл. отложений (обусловленных,
напр., жесткостью воды) на пов-сти теплоэнергетич. оборудования, как хелатирующий
агент, антикоагулянт крови и стабилизатор пищ. продуктов, для удаления
следов металлов из растит. масел и лек. в-в, а также радиоактивных и токсичных
металлов из организма и с разл. пов-стей, для произ-ва ПАВ (в т. ч. жидких
мыл и шампуней), средств защиты растений, в качестве умягчителя воды.
Лит.: Порай-Кошиц М.А., Полыяова
Т. Н., "Коорд. химия", 1984, т. 10, № 6, с. 725-72; Дятлова Н.М., Темкина
В.Я., Попов К. И., Комплексоны и комплексонаты металлов, М., 1988; Martell
A.E., Smith R.M., Critical stability constants, v. 1,N. Y.-L., 1974.
В. Я. Темкина, Н. М. Дятлова.
|

