ФТОРИСТЫЙ ВОДОРОД
HF, бесцв. газ или подвижная жидкость, дымящая на воздухе; т. пл. -83,36
0C, т. кип. 19,520C; tкрит 230
0C, dкрит 0,29 г/см3, ркрит
6,49 МПа; 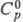 29,14 Дж/(моль·К);
29,14 Дж/(моль·К); 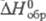 -273,3 кДж/моль;
-273,3 кДж/моль;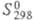 173,675 Дж/(моль·К);
173,675 Дж/(моль·К); 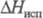 =
7,489 - 43,9(7- 292,69) кДж/моль (250
=
7,489 - 43,9(7- 292,69) кДж/моль (250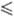 T
T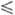 390
К); ур-ние температурной зависимости давления пара над Ф. в. lgp (Па)
= 0,21317 - 918,24/Т + + 3,21542 lgT, где 193
390
К); ур-ние температурной зависимости давления пара над Ф. в. lgp (Па)
= 0,21317 - 918,24/Т + + 3,21542 lgT, где 193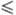 T
T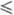 378
К. Плотн. жидкого HF близка к плотн. воды: d = 1,0020 - 2,2625·10-3t
+ 3,125·10-6t г/см3, где -74
378
К. Плотн. жидкого HF близка к плотн. воды: d = 1,0020 - 2,2625·10-3t
+ 3,125·10-6t г/см3, где -74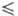 t
t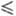 42
0C;
42
0C; 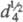 0,98.
Чистый жидкий HF почти не ионизирован, r 10-6
Ом·см (0 0C); следовые кол-ва примесей, в т. ч. воды, резко понижают
r.
0,98.
Чистый жидкий HF почти не ионизирован, r 10-6
Ом·см (0 0C); следовые кол-ва примесей, в т. ч. воды, резко понижают
r.
Характерное св-во HF -
склонность к ассоциации. Средняя степень ассоциации в жидкости n = 6.
В газовой фазе могут присутствовать линейные и циклич. олигомеры с n —
4,6-12.
Наиб. устойчив циклич. (HF)6.
Ф. в. реагирует со мн.
простыми в-вами с образованием фторидов
, с оксидами - оксифторидов или
фторидов, замещает галоген в галогенидах металлов, с фторидами щелочных и др.
одновалентных металлов образует гидрофториды металлов
, с фторидами и
оксифторидами мн. элементов в присут. воды - фторсодержащие к-ты, напр. H2SiF6,
HBF4.
Ф. в. неограниченно раств.
в воде с образованием фтористоводородной кислоты
. Сам HF - хороший р-ритель
для мн. в-в. Наиб. р-римость характерна для SbF5 (смешивается неограниченно),
TlF (580 г в 100 г HF при 12 oС) и CsF (199 г в 100 г HF при 10 0C).
Р-римость фторидов щелочных металлов (кроме LiF) в HF в 2-4 раза ниже, чeм в
воде, BaF2, PbF2 и CoF2 - в сотни, BeF2
- в тысячи, a AgF - в сотни тысяч раз больше, чем в воде, что связано с сильной
сольватацией фторид-иона в HF.
Ф. в.- сильная к-та, ф-ция
кислотности Гаммета -15,05, однако даже небольшой избыток фторид-ионов резко
ее снижает.
Осн. способ получения HF
- р-ция флюорита CaF2 с H2SO4, к-рую проводят
в трубчатых вращающихся и шнековых печах при 120-180 0C. Реакционные
газы очищают от пыли, конденсируют из них HF и подвергают его двухступенчатой
ректификации. Менее распространены сернокислотное разложение NH4HF2
и термич. разложение NH4HF2. В лаборатории HF удобно получать
термич. разложением гидрофторидов.
Ф. в.- катализатор гидрирования,
дегидрирования, алкили-рования в орг. химии, реагент в произ-ве хладонов и фторопластов,
UF4, AlF3 и др., исходное в-во для получения F2,
фторсульфоновой к-ты. Мировое произ-во (вместе с фтористоводородной к-той) св.
1 млн. т в год (1980-е гг.).
Ф. в. раздражает дыхательные
пути, является сильнейшим водоотнимающим в-вом и при попадании на кожу вызывает
образование долго не заживающих язв, а при длительной экспозиции - обугливание.
ПДК в атм. воздухе 0,005 мг/м3, в воде 0,05 мг/л.
Жидкий Ф. в. хранят в стальных
герметичных танках и цистернах, а также в баллонах аммиачного типа, имеющих
защитную окраску с красной полосой.
Лит.: Запольская
М.А., Зенкевич Н.Г., Комарова Е.Г., Физико-химические свойства фтористого водорода,
M., 1977; Раков Э.Г., Химия и технология неорганических фторидов, M., 1990.
Э.Г. Раков.
|

