ФТОРОБОРАТЫ
, соли
фтороборных к-т. Важнейшие из них - тетрафторобораты (T.) - производные тетра-фтороборной
к-ты HBF4, известной в виде водных р-ров, обладающих сильнокислой
р-цией; их получают взаимод. фтористоводородной к-ты с H3BO3
или BF3. T. металлов синтезируют действием HBF4 на металлы,
оксиды или карбонаты металлов,
а также взаимод. BF3 с фторидами металлов, H3BO3
- с гидрофторидами металлов и т. п.
Т.- кристаллы, обычно изоморфные
с перхлоратами. При натр, диссоциируют с отщеплением BF3. T. щелочных
и мн. тяжелых металлов раств. в воде. Свежеприготовленные водные р-ры T. щелочных
металлов имеют нейтральную р-цию. В этих р-рах происходит медленный гидролиз
с образованием в первую очередь ионов гидроксифторобората [BF3OH]-.
Только в очень разб. р-рах наблюдается дальнейший гидролиз с образованием ионов
[BF2(OH)2]-.
T. щелочных металлов, NH4+
и Tl(I) кристаллизуются из водных р-ров в безводном состоянии (только для LiBF4
известны моно- и тригидраты). T. магния и мн. двухвалентных металлов (Fe,
Cu, Со, Ni, Mn, Zn, Pb и др.) образуют гексагидраты, Ag - моногидрат. В их молекулах
вода входит во внутр. сферу катиона, напр. [Cd(H2O)6]BF4.
Гидраты T. тяжелых металлов нестойки и при натр. разлагаются с выделением паров
воды и BF3. Более устойчивы соед. MF2·BF3,
образующиеся при действии паров BF3 на фториды металлов. Предполагают,
что их строение [MF]BF4.
T. многих металлов легко
образуют аммиакаты, напр. [Ni(NH3)6](BF4)2,
[Ag(NH3)2]BF4. Эти соед. при натр, разлагаются
с образованием гл. обр. фторида металла и BF3·NH3; аммиакаты
T. кадмия, Ni, Со(III), Cr(III) мало раств. в воде. Описаны многочисленные амминокомплексы
T. с орг. основаниями.
Известны T. азотсодержащих
оснований - нитрозила NOBF4, нитрозония NO2BF4,
гидразония N2H5BF4, малоустойчивых сложных
катионов - Cl2OBF4, NSBF4, IOBF4
и др. В большинстве они разрушаются при действии воды.
Существует большое число
T. орг. оснований, напр. [(C4H9)4N]BF4,
C6H5N2BF4, (C6H5)3CHBF4,
оксониевых соед., напр. (C2H5)3OBF4.
T. калия KBF4
- бесцв. кристаллы с ромбич. решеткой (а = 0,785 нм, b = 0,568
нм, с = 0,737 нм, z = 4, пространств. группа Рпта); при
283 0C переходит в кубич. модификацию (а = 0,726 нм),  перехода 13,8 кДж/моль; т.пл. 570 0C, т.разл. 930 0C;
плотн. 2,55 г/см3;
перехода 13,8 кДж/моль; т.пл. 570 0C, т.разл. 930 0C;
плотн. 2,55 г/см3; 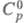 115 Дж/(моль·К);
115 Дж/(моль·К); 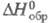 -1884 кДж/моль,
-1884 кДж/моль, 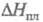 18,0 кДж/моль;
18,0 кДж/моль;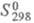 130
Дж/(моль·К); плохо раств. в воде (0,44% по массе при 20 0C, 6,27%
при 100 0C), этаноле, диэтиловом эфире.
130
Дж/(моль·К); плохо раств. в воде (0,44% по массе при 20 0C, 6,27%
при 100 0C), этаноле, диэтиловом эфире.
T. натрия NaBF4
- бесцв. кристаллы с ромбич. решеткой (а - 0,625 нм, b = 0,677
нм, с = 0,682 нм, z = 4, пространств, группа Cmcm); при 243 0C
переходит в моноклинную (по др. данным, в кубическую) модификацию,  перехода 6,7 кДж/моль; т. пл. 406 0C (с частичным разл.); плотн.
2,47 г/см3;
перехода 6,7 кДж/моль; т. пл. 406 0C (с частичным разл.); плотн.
2,47 г/см3; 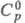 120,2 Дж/(моль·К);
120,2 Дж/(моль·К); 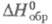 -1845 кДж/моль,
-1845 кДж/моль, 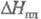 13,6 кДж/моль;
13,6 кДж/моль; 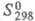 145,3 Дж/(моль·К); раств. в воде (50,7% по массе при 25 0C), плохо
- в этаноле (0,47% при 25 0C), метаноле (4,17% при 25 0C),
ацетоне (~ 1%), не раств. в диэтиловом эфире.
145,3 Дж/(моль·К); раств. в воде (50,7% по массе при 25 0C), плохо
- в этаноле (0,47% при 25 0C), метаноле (4,17% при 25 0C),
ацетоне (~ 1%), не раств. в диэтиловом эфире.
T. аммония NH4BF4
- бесцв. кристаллы с ромбич. решеткой (а = 0,906 нм, b = 0,564
нм, с = 0,723 нм, z = 4, пространств, группа Рпта);
плотн. 1,88 г/см3; при 199,5 0C переходит в кубич.
модификацию (а = 0,755 нм); т. пл. 487 0C (под давлением);
т. возг. 350 0C; раств. в воде (20,5% по массе при 25 0C),
плохо - в этаноле (0,7%), не раств. в ацетоне, бензоле, хлороформе, пиридине.
T. натрия, калия и аммония
- компоненты электролитов при рафинировании и получении покрытий цветных металлов,
флюсов для сварки и пайки, формовочных составов при литье Al и Mg и их сплавов,
добавки к смазочно-ох-лаждающим жидкостям при обработке металлов давлением,
фторирующие агенты, гербициды. T. лития и натрия - исходные в-ва для получения
тетрагидридоборатов, T. аммония -консервант для древесины, антипирен для полимеров.
T. тяжелых металлов (Fe, Zn, Hg и др.) - катализаторы р-ций полимеризации, гидролиза,
формилирования и др. в орг. синтезе. Такие Т., как NF4BF4,
N2F5BF4, используются в хим. лазерах. T. нитрозила
и нитрозония - реагенты для нитрозирования и нитрования в орг. синтезе. T. орг.
оснований используют
в орг. синтезе, в частности для фториро-вания.
Известны соли и др. фтороборных,
а также оксо- и гидро-ксофтороборных к-т, в частности гидроксотрифтороборной
и дигидроксодифтороборной к-т (эти к-ты иногда рассматривают как гидраты BF3),
напр. K2B2F9, NaHBF3, BaBOF3,
KBF3(OH).
Лит. см. при ст.
Бора трифторид
. П. И. Федоров.
|

