ФУРФУРОЛ
(фурфураль,
2-фуранкарбальдегид), мол.м. 96,09; быстро темнеющая на воздухе жидкость с запахом
ржаного хлеба; т. пл. -38,7 0C, т. кип. 161,5 0C, 39,9/8
мм рт. ст.; 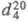 1,1594;
1,1594; 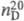 1,5255; h 1,49 мПа с (25 0C); g 40,7 мН/м (29,9 0C);
m 12,04·10-30 Кл·м; ур-ние температурной зависимости давления
пара
1,5255; h 1,49 мПа с (25 0C); g 40,7 мН/м (29,9 0C);
m 12,04·10-30 Кл·м; ур-ние температурной зависимости давления
пара 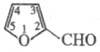 (313,05-443,75 К): lg р (мм рт. ст.) = 8,0564--2251/Т; ркрит
5,502 МПа, tкрит 397 0C;
(313,05-443,75 К): lg р (мм рт. ст.) = 8,0564--2251/Т; ркрит
5,502 МПа, tкрит 397 0C; 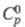 1,75 кДж/(кг·К);
1,75 кДж/(кг·К); 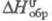 -200 кДж/моль;
-200 кДж/моль;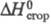 -2,34 МДж/моль; e 38 (бензол, 25 0C). Смешивается со мн. орг.
р-рителями, раств. в воде (8,3% по массе при 20 0C и 19,9% при 90
0C); перегоняется с водяным паром. Образует азеотропные смеси с водой
(т. кип. 97,85 0C, 35% Ф. по массе), пентахлорэтаном (т. кип. 156,75
0C, 40% Ф.) и бромбен-золом (т. кип. 153,3 0C, 23% Ф.).
-2,34 МДж/моль; e 38 (бензол, 25 0C). Смешивается со мн. орг.
р-рителями, раств. в воде (8,3% по массе при 20 0C и 19,9% при 90
0C); перегоняется с водяным паром. Образует азеотропные смеси с водой
(т. кип. 97,85 0C, 35% Ф. по массе), пентахлорэтаном (т. кип. 156,75
0C, 40% Ф.) и бромбен-золом (т. кип. 153,3 0C, 23% Ф.).
По хим. св-вам Ф.- ароматич.
альдегид
. В присут. солей синильной к-ты вступает в бензоиновую конденсацию
,
образуя фуроин (ф-ла I), к-рый при окислении превращается в фурил (II);
последний при нагр. с едкими щелочами перегруппировывается в фуриловую к-ту
(III):
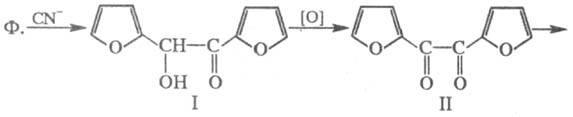
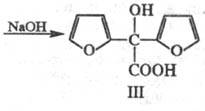
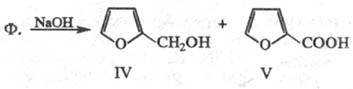
Нагревание с р-рами щелочей
приводит по р-ции Канниц-царо к смеси фурфурилового спирта (ф-ла IV; т. пл.
-14,6 0C, т. кип. 171 0C, ,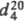 1,1285;
1,1285; 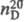 1,4868) и пирослизевой к-ты (V):
1,4868) и пирослизевой к-ты (V):
Ф. легко конденсируется
с соед., имеющими активные метильные или метиленовые группы по р-ции Перкина;
так, нагревание с диацетамидом и ацетатом Na при 180 0C дает смесь
амида 3-(2-фурил)акриловой к-ты и пирослизевой к-ты. Конденсация Ф. с фурфуриловым
спиртом и др. спиртами, а также с фенолами, кетонами и альдегидами приводит
к фурановым смолам.
Электроф. замещение Ф.
идет в положение 5. При хлорировании в присут. бензоилпероксида и нитровании
дымящей HNO3 Ф. превращается соотв. в 5-хлор- и 5-нитропроизвод-ные;
взаимод. с HgCl2 приводит к 5-меркурхлориду Ф. При действии NH3
в присут. CH3OH (150-250 С, 20,8 МПа, кат. Со) Ф. превращается в
пиперидин.
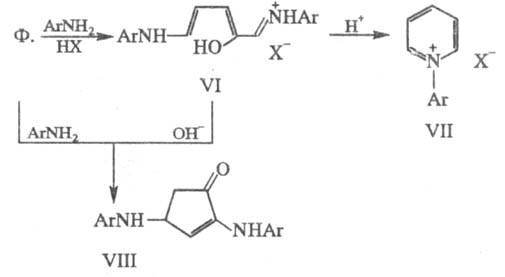
При действии на Ф. первичных
ариламинов в кислой среде происходит раскрытие цикла с образованием соли VI,
к-рая под влиянием к-ты циклизуется в пиридиниевую соль VII, а при действии
оснований - в замещенный циклопенте-нон VIII; последний м. б. получен непосредственно
при взаимод. Ф. с ариламином в отсутствие к-ты:
Одна из особенностей Ф.-
автоокисление с образованием муравьиной и 2-формилакриловой к-т. Окисление Ф.
в разл. условиях приводит к расщеплению цикла Ф. с образованием смеси малеиновой
к-ты и малеинового ангидрида (200-400 0C, кат. V2O5),
пирослизевой к-ты (50 0C, кат. Ag2O, щелочная среда),
смеси 3-гидроксипирослизевой к-ты и 3-гидроксифур-фуррла (H2O2,
40 0C), фумаровой к-ты (нагревание с NaClO3, кат. V2O5).
При гидрировании на CuO/Cr2O3 (5-10 МПа, 200-250 0C)
Ф. превращается в сильван (2-метилфуран), при 150-170 °С-в фурфуриловый
спирт, дальнейшее гидрирова-ние к-рого над Ni-Ренея при 230-250 0C
и 5-10 МПа ведет к тетрагидрофурфуриловому спирту. В присут. Zn(CrO2)2
Ф. декарбонилируется в фуран.
Ф. получают гидролизом
растит. пентозансодержащего сырья (кукурузные початки, овсяная и рисовая шелуха,
хлопковые коробочки и др.) разбавленными минер. к-тами с непрерывной отгонкой
продукта с паром.
Ф.- сырье для синтеза фурана,
сильвана, фурфурилового спирта, ТГФ, фурановых смол, лек. средств (напр., фураци-лина)
и пестицидов, экстрагент при очистке нефти и растит, масел от углеводородов.
Т.всп. 64 0C,
т.самовоспл. 290 0C, КПВ 2,1-19%. Ф.-нервный яд, обладает раздражающим
действием; ЛД50 126
мг/кг (крысы, перорально); ПДК в атм. воздухе 0,05 мг/м3, в воде
водоемов 1 мг/л.
Лит.: Общая органическая
химия, пер. с англ., т. 9, 1985, с. 163; Kiik-Oth-mer encyclopedia, 3 ed., v.
10, N. Y., 1980. См. также лит
. при ст. Фуран
.
С. К. Смирнов, С. С.
Смирнов.
|

