ГАЛЛИЙ
(от Gallia-Галлия, лат. назв. Франции;
лат. Gallium) Ga, хим. элемент III гр. периодич. системы, ат. н. 31, ат.
м. 69,72. Прир. Г. состоит из изотопов 69Ga (61,2%) и 71Ga
(38,8%), поперечное сечение захвата тепловых нейтронов соотв. 2,1*10-28
и 5,1*10-28 м2. Конфигурация внеш. электронной оболочки
4s24p1; степень окисления + 1 и +3; энергия ионизации
Ga° -> Ga+ -> Ga2+ -> Ga3+ соотв. равна
5,998, 20,5144 и 30,66 эВ; электроотрицательность по Полингу 1,6; атомный
радиус 0,139 нм; ионный радиус для Ga3 (в скобках указано координац.
число) 0,061 нм (4), 0,069 нм (5) и 0,076 нм (6).
Содержание Г. в земной коре 1,8*10-3 %
по массе, в воде морей и океанов 3*10-5 мг/л. В природе встречается
в виде чрезвычайно редких минералов - зенгеита Ga(OH)3, галлита
CuGaS2 и др. Является спутником Al, Zn, Ge, Fe; содержится в
сфалеритах (до 0,018% по массе), нефелине (среднее содержание 0,004%),
натролите (до 0,1%), бокситах (среднее содержание 0,005%), германите (0,7-1,8%),
алуните (0,001-0,06%), в углях и железных рудах нек-рых месторождений и
др. Потенциальные мировые запасы Г. в бокситах св. 1 млн. т, в цинковых
рудах ок. 10000 т.
Свойства. Г.-светло-серый металл с синеватым оттенком.
Расплав Г. может находиться в жидком состоянии при т-рах ниже т-ры плавления
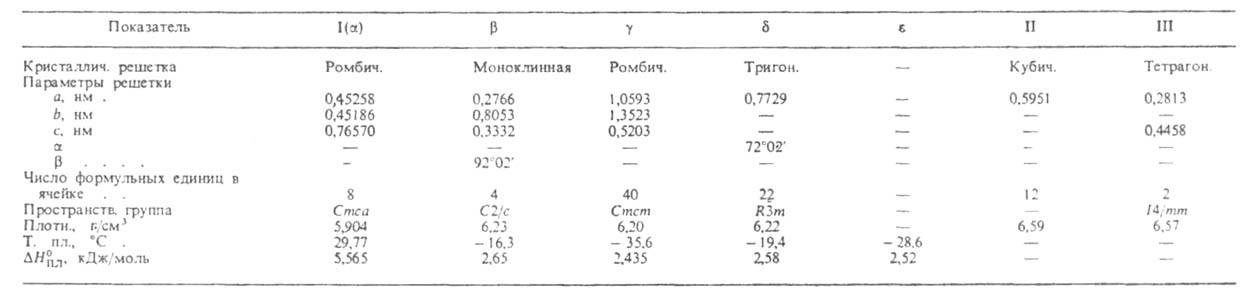
в течение неск. месяцев. Кристаллич. решетка устойчивой модификации I (или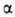 ;
см. табл. и рис.) образована двухатомными молекулами с длиной связи 0,244
нм, к-рые сохраняются и в жидком металле; в парах Г. одноатомен. Из переохлажденного
диспергиров. металла кристаллизуются неустойчивые модификации-
;
см. табл. и рис.) образована двухатомными молекулами с длиной связи 0,244
нм, к-рые сохраняются и в жидком металле; в парах Г. одноатомен. Из переохлажденного
диспергиров. металла кристаллизуются неустойчивые модификации-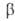 ,
, ,
,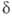 и
и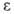 ;
при давлениях выше 1,14 и 3,0 ГПа обнаружены модификации соотв. II и III;
существуют также еще две метастабильные фазы Г. Конденсацией паров при
4,2 К получен аморфный галлий. Т. кип. 2205 °С; плотность жидкого 6,0948
г/см3; Сop 26,07 Дж/(моль*К);
;
при давлениях выше 1,14 и 3,0 ГПа обнаружены модификации соотв. II и III;
существуют также еще две метастабильные фазы Г. Конденсацией паров при
4,2 К получен аморфный галлий. Т. кип. 2205 °С; плотность жидкого 6,0948
г/см3; Сop 26,07 Дж/(моль*К);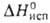 271 кДж/моль (О К); So298 40,81 Дж/(моль*К). Ур-ния
температурных зависимостей давления пара над жидким в-вом, плотности и
поверхностного натяжения:
271 кДж/моль (О К); So298 40,81 Дж/(моль*К). Ур-ния
температурных зависимостей давления пара над жидким в-вом, плотности и
поверхностного натяжения:

Температурный коэф. объемного расширения 5,5*10-5
К-1,
линейного расширения поликристаллич. Г. 2,0*10-5 К-1,
жидкого 10,9*Ю-5 К-1; теплопроводность 4,82*10-3
Вт/(м-К),
жидкого 2,85 х х 10-3 Вт/(м*К) при 77 °С.
При комнатной т-ре Г. пластичен и м. б. прокатан в
тонкие листы. Твердость по Бринеллю 25 МПа;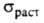 20-38 МПа; относит. удлинение 2-40%;
20-38 МПа; относит. удлинение 2-40%;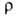 0,449 мкОм*м (28°С), жидкого 0,258 мкОм*м (30°С); температурный коэф.
0,449 мкОм*м (28°С), жидкого 0,258 мкОм*м (30°С); температурный коэф.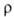 3,96*10-3 К-1, жидкого 8,15*10-4 К-1
(30-100°С). Стандартный электродный потенциал (Ga/Ga3+) в р-ре
соли Г. -0,56 В, в щелочном р-ре —1,326 В. Твердый Г. диамагнитен, жидкий
слегка парамагнитен (магн. восприимчивость 210-9 и мало зависит
от т-ры). При 1,09 К Ga I переходит в сверхпроводящее состояние. В жидком
Г. раств. In, Sn, Zn, Al, Au, Ag, Си. Сплавы на основе Г., жидкие при комнатной
т-ре, наз. галламами.
3,96*10-3 К-1, жидкого 8,15*10-4 К-1
(30-100°С). Стандартный электродный потенциал (Ga/Ga3+) в р-ре
соли Г. -0,56 В, в щелочном р-ре —1,326 В. Твердый Г. диамагнитен, жидкий
слегка парамагнитен (магн. восприимчивость 210-9 и мало зависит
от т-ры). При 1,09 К Ga I переходит в сверхпроводящее состояние. В жидком
Г. раств. In, Sn, Zn, Al, Au, Ag, Си. Сплавы на основе Г., жидкие при комнатной
т-ре, наз. галламами.
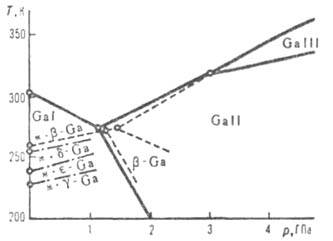
Диаграмма состояния галлия (ж-жидкость).
СВОЙСТВА ПОЛИМОРФНЫХ МОДИФИКАЦИЙ ГАЛЛИЯ
По хим. св-вам Г. весьма сходен с А1. На воздухе на
повети металла образуется пленка оксида, предохраняющая Г. от дальнейшего
окисления (см. Галлия оксиды
). При нагр. Г. с водой под давлением
образуется GaOOH. С минер. к-тами Г. медленно реагирует уже на холоду,
образуя соли; при взаимод. с р-рами щелочей, а также с Na2CO3
и К2СО3 образуются гидроксогаллаты, содержащие ионы
Ga(OH)4- и, возможно, Ga(OH)63-
и Ga(OH)2-. Г. реагирует с С12 и F2 при
комнатной т-ре, с Вr2 - уже при — 35°С (ок. 20°С - с воспламенением),
с I2-при нагревании. С Н2, С, N2, Si и
В не взаимодействует. При высоких т-рах Г. разрушает разл. материалы сильнее,
чем расплав любого др. металла. Графит и W устойчивы к действию Г. до 800°С,
алунд и ВеО до 1000°С, Та до 450°С, Мо и Nb до 400°С, Be до 600°С, Re до
700°С. С металлами (кроме металлов подгрупп Пб, IIIa, IVa и Bi) Г. образует
галлиды, из к-рых особый интерес представляют Nb3Ga и V3Ga.
Последний образуется при 1300°С; т-ра перехода в сверхпроводящее состояние
для V3Ga 16,8 К.
С мышьяком, фосфором и сурьмой Г. образует соотв.
галлия арсенид
, галлия фосфид
и галлия антимонид
, с S, Se и Те при
600-1100°С-халькогениды Ga,X3, Ga2X2,
Ga2X, Ga4X5, Ga2X5.
Сесквисульфид Ga2S3-белые (плотн. 3,650 г/см3),
светло-желтые (3,74 г/см3) или оранжевые кристаллы; т. пл. 1125°С.
Сульфид Ga2S2-желтые кристаллы; т. пл. 1015°С; плотн.
3,75 г/см3. Селенид Ga,Se2-темно-красные кристаллы;
т. пл. 960°С; плотн. 5,03 г/см3; используется как полупроводник.
Сесквителлурид Ga2Te3-черные кристаллы; т. пл. 810°С;
плотн. 5,582 г/см3.
При взаимод. Ga или его соединений с NH3
при 1050-1200°С получают нитрид GaN-кристаллы, решетка типа вюрцита (а
= 0,3186нм, b = 0,5178нм); т. пл. ~ 1700°С (под давлением N2
более 20 МПа); плотн. 6,1 г/см3;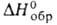 — 109,8 кДж/моль; ширина запрещенной зоны 3,39 эВ (27 °C; не взаимод. с
водой, р-рами минеральных к-т и царской водкой, медленно реагирует с р-рами
щелочей, окисляется на воздухе при 800 °С. GaN-материал для светодиодов
и прозрачных диэлектрич. покрытий; перспективен как материал инжекционных
лазеров.
— 109,8 кДж/моль; ширина запрещенной зоны 3,39 эВ (27 °C; не взаимод. с
водой, р-рами минеральных к-т и царской водкой, медленно реагирует с р-рами
щелочей, окисляется на воздухе при 800 °С. GaN-материал для светодиодов
и прозрачных диэлектрич. покрытий; перспективен как материал инжекционных
лазеров.
Из солей Г. Наиб. значение имеет трихлорид GaCl3
(см. Галлия галогениды
). Сульфат кристаллизуется из сернокислых
р-ров в виде Ga2(SO4)3*20H2O;
раств. в воде (170 г в 100 г); обезвоживается при 40-360°С; выше 500°С
разлагается; с сульфатами щелочных металлов (кроме Li и Na) и аммония образует
квасцы. Нитрат Ga(NO3)3 кристаллизуется в виде нона-
или гептагидрата; хорошо раств. в воде (295 г нонагидрата в 100 г), спирте,
не раств. в эфире; гигроскопичен, расплывается на воздухе. Ортофосфат GaPO4-кристаллы;
т. пл. 1670°С; плотн. 3,26 г/см3; не раств. в воде; получают
действием гидрофосфатов щелочных металлов или Н3РО4
на р-ры солей Г.
Из водных р-ров солей Г. (при рН 3,0-4,1) и галлатов
(при рН 9,7-6,4) осаждается гидроксид Ga(OH)3*xH2O.
Кислотные св-ва Ga(OH)3 (или ортогаллиевой к-ты H3GaO3)
выражены сильнее основных; он является более сильной к-той, чем А1(ОН)3,
поэтому р-ры солей к-т Г.-галлатов устойчивее р-ров алюминатов. При нагр.
гидроксида до ~ 400 °С образуется GaOOH (или метагаллиевая к-та HGaO2),
к-рый выше 550 °С переходит в Ga2O3. Из галлатов
Наиб. распространены метагаллаты (моногаллаты), содержащие одно- и двухзарядные
катионы. Менее распространены ортогаллаты; они образуются со щелочными
и щел.-зем. металлами, а также с РЗЭ. Известны нестехиометрич. галлаты
щелочных металлов, напр. Na2O*5,3Ga2O3
и Na2O*(5,3 - 7,0)Ga2O3, к-рые находят
применение как твердые электролиты. РЗЭ (начиная с Рг) образуют галлаты
типа M3Ga5O12 и M4Ga2O9.
Получение. Осн. источник Г.-алюминатные р-ры, получаемые
при переработке глинозема и содержащие до 250 мг/л Г. После отделения осн.
массы А1 галлиевый концентрат осаждается, напр. карбонизацией (пропусканием
СО2), затем его обрабатывают водой в автоклаве или Са(ОН)2,
после чего большая часть Г. переходит в р-р; карбонизацией полученных р-ров
осаждают вторичный концентрат Г. (ок. 1% Ga2O3).
Его растворяют в щелочи, обрабатывают Са(ОН)2 и электролизом
этого р-ра (1,5-2 г/л Ga2O3 и ~ 60 г/л А12О3)
выделяют металлич. Г.
При переработке бокситов по способу Байера Г. концентрируется
в маточных р-рах (остающихся после отделения осн. массы А1), из к-рых его
выделяют электролизом на ртутном катоде. Образовавшуюся при этом натриево-галлиевую
амальгаму (до 1% Г.) разлагают водой или р-ром щелочи и из полученного
р-ра Г. выделяют электролитически. Вместо электролиза на ртутном катоде
можно выделять Г. цементацией (вытеснением ионов одного металла из р-ра
др. металлом) его на амальгаме Na. Разработан способ выделения Г. из алюминатных
р-ров путем цементации его на галламе А1 при 80 °С. Для выделения Г. галламу
разлагают водой. Перспективен метод экстракции Г. из алюминатных р-ров
фенолами. Источниками для получения Г. могут служить также продукты переработки
железных, титановых, германиевых и др. руд.
Рафинирование Г. обычно включает промывку металла
водой и к-тами, фильтрование, вакуумную обработку при 800-1100°С и давл.
1*10-3гПа, очистку электролизом в щелочном электролите (15-20%
NaOH). Используют также частичное окисление металла воздухом или О2
с послед. отделением образующегося Ga2O3 фильтрованием,
а также обработку аммиаком при 800 °С. Для получения Г. высокой чистоты
применяются методы зонной плавки, направленной кристаллизации или вытягивания
слитка из расплава. Используется также метод очистки через галлийорг. соед.,
в частности через Ga(C2H5)3. Перспективен
метод получения Г. высокой чистоты через GaCl3, к-рый м. б.
очищен перегонкой, ректификацией, зонной плавкой или противоточной кристаллизацией
в колоннах; Г. может быть получен из него электролизом водного р-ра или
восстановлением Н2 в парах при 600-700°С
Определение. Качественно Г. обнаруживают дуговым или
искровым спектральным методом (характеристич. линии 417,206; 403,298; 294,364;
287,424 нм), а также по флуоресценции р-ров соед. Г. и 8-гидроксихинолина
в СНС13 или родамина В в С6Н6. При количеств.
определении Г. отделяют от др. элементов экстракцией из солянокислых р-ров
эфиром, бутилацетатом и др. Определяют Г. преим. титрованием р-ром комплексона
III либо фотометрически (флуорометрически) с использованием родамина В,
8-гидроксихинолина, сульфонафтолазорезорцина, галлиона или других орг.
реагентов.
Применение. Ок. 97% производимого Г. используется
для получения соед., обладающих полупроводниковыми св-вами (напр., GaAs).
Сам Г. применяется в радиоэлектронике для "холодной пайки" керамич. и металлич.
деталей, для легирования Ge и Si, получения оптич. зеркал спец. назначения.
Г. может заменять ртуть в выпрямителях тока. Добавка Г. в кач-ве легирующей
присадки к Mg и его сплавам увеличивает их прочность. Г. и его эвтектич.
сплав с In используется в радиац. контурах реакторов. Предложено использование
галлам в кач-ве теплоносителей в ядерных реакторах, для устройства гидравлич.
затворов, плавких предохранителей и т.п.
Г.-малотоксичный элемент. Из-за низкой т-ры плавления
слитки Г. рекомендуется транспортировать в пакетах из полиэтилена, к-рый
плохо смачивается расплавом Г.
Произ-во Г. в капиталистам, странах ок. 50 т/год (1980).
Существование Г. было предсказано Д. И. Менделеевым
в 1871, элемент открыл и выделил П. Э. Лекок де Буабодран в 1875.
Лит.: Шека И. А, Чаус И. С, Мнтюрева Т. Т.,
Галлий, К., 1963; Еремин Н. И., Галлий, М., 1964; Рустамов П. Г., Халькогениды
галлия, Баку, 1967; Дымов А. М., Савостин А. П., Аналитическая химия галлия,
М., 1968; Иванова Р. В., Химия и технология галлия, М., 1973; Коган Б.
И., Вершковская О.В., Славиковская И.М., Галлий. Геология, применение,
экономика, М., 1973; Яценко С. П., Галлий. Взаимодействие с металлами,
М., 1974; Процессы экстракции и сорбции в химической технологии галлия,
Алма-Ата, 1985; Химия и технология редких и рассеянных элементов, под ред.
К. А. Большакова, 2 изд., т. 1, М., 1976, с. 223-44; Федоров П. И., Мохосоев
М. В.. Алексеев Ф.П., Химия галлия, индия и таллия, Новосиб., 1977. П.
И. Федоров.

