ГАЛОГЕНКАРБОНОВЫЕ КИСЛОТЫ
, содержат в молекуле карбоксильную группу и атомы галогенов.
Назв. Г. к. производят от назв. карбоновых к-т с указанием числа атомов
галогена и их положения относительно карбоксильной группы, напр. С1СН2СООН-хлоруксусная
к-та, СН2С1СНС1СООН -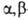 -дихлорпропионовая.
-дихлорпропионовая.
Г. к.
вступают в р-ции, характерные для карбоновых к-т и галогензамещенных углеводородов.
Взаимное влияние атома галогена и группы СООН быстро уменьшается с удалением
их друг от друга. Так, кислотность снижается в ряду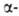 Г.
к.,
Г.
к.,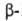 Г.
к.,
Г.
к., Г.
к. Тригалогенуксусные к-ты легко декарбоксилируются. Карбоксильная группа
сильно увеличивает способность галогена к нуклеоф. замещению: На1СН2СООН
+ НА -> АСН2СООН + HHal, где А = ОН, OR, NH2, SH,
CN. Под действием водных р-ров щелочей наряду с замещением атома галогена
от
Г.
к. Тригалогенуксусные к-ты легко декарбоксилируются. Карбоксильная группа
сильно увеличивает способность галогена к нуклеоф. замещению: На1СН2СООН
+ НА -> АСН2СООН + HHal, где А = ОН, OR, NH2, SH,
CN. Под действием водных р-ров щелочей наряду с замещением атома галогена
от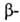 Г.
к. отщепляется HHal, напр.: RCH(Hal)CH2COOH -> RCH=CHCOOH +
HHal. При гидролизе
Г.
к. отщепляется HHal, напр.: RCH(Hal)CH2COOH -> RCH=CHCOOH +
HHal. При гидролизе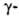 Г.
к. и
Г.
к. и Г.
к. образуются лактоны, напр.: ,
Г.
к. образуются лактоны, напр.: ,
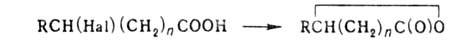
где n=2,3
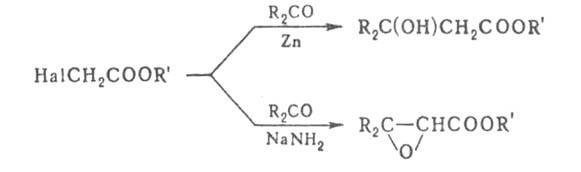
Эфиры Г.
к. при взаимод. с карбонильными соед. в присут. сильных оснований превращ.
в эфиры глицидных к-т (р-ция Дарзана), в присут. Zn - в эфиры
Г.
к. при взаимод. с карбонильными соед. в присут. сильных оснований превращ.
в эфиры глицидных к-т (р-ция Дарзана), в присут. Zn - в эфиры гидроксикарбоновых
к-т (р-ция Реформатского), напр.:
гидроксикарбоновых
к-т (р-ция Реформатского), напр.:
 Г. к. и их производные присоединяются к непредельным соед. в присут. трет-бутилпероксида:
На1СН2СООН + RCH=CH2 -> RCH2CH2CH(Hal)COOH,
а также вступают с ними в р-цию теломеризации.
Г. к. и их производные присоединяются к непредельным соед. в присут. трет-бутилпероксида:
На1СН2СООН + RCH=CH2 -> RCH2CH2CH(Hal)COOH,
а также вступают с ними в р-цию теломеризации.
Методы
получения Г. к.:
1. Введение
галогена в карбоновые к-ты-прямое галогенирование
к-т или их производных в присут. катализаторов (р-ция Гелля-Фольгарда-Зелинского);
присоединение галогенов или галогеноводородов к непредельным к-там; замещение
гидроксигруппы гидроксикислот (оксикислот) галогеном и замещение галогена
галогенирование
к-т или их производных в присут. катализаторов (р-ция Гелля-Фольгарда-Зелинского);
присоединение галогенов или галогеноводородов к непредельным к-там; замещение
гидроксигруппы гидроксикислот (оксикислот) галогеном и замещение галогена Г.
к. другим галогеном. Перфторкарбоновые к-ты получают электрохим. фторированием.
Г.
к. другим галогеном. Перфторкарбоновые к-ты получают электрохим. фторированием.
2. Введение
карбоксильной группы в галогенсодержащие соед.-окисление галогеноспиртов,
галогенальдегидов, моно- и дигалогеналкенов; превращ. ди- и полигалогензамещенных
(особенно содержащих разные галогены или одинаковые, но различающиеся подвижностью)
в металлоорганические соединения с последующим их карбоксилированием; гидролиз
дигалогенметиленовой и тригалогенметильной групп.
Многие
Г. к. применяют в пром-сти; так, монохлоруксусную к-ту - в произ-ве красителей,
карбоксиметилцеллюлозы, 2,4-дихлор- и 2,4,5-трихлорфеноксиуксусных к-т.
Дихлоруксусная и хлорпропионовая
к-ты используются в синтезе лек. в-в (напр., пантотеновой к-ты),
хлорпропионовая
к-ты используются в синтезе лек. в-в (напр., пантотеновой к-ты),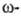 хлорэнантовая
и
хлорэнантовая
и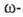 хлорпеларгоновая
к-ты - для получения полиамидов, нек-рые фторкислоты - для синтеза фторсодержащих
полимеров. Na-Соли ряда Г. к. - гербициды. Na-Соль цис-3-хлоракриловой
к-ты (акрофол) - дефолиант хлопчатника, Na-соль фторуксусной к-ты-инсектицид
и родентицид. См., напр., Хлоруксусные кислоты
, Xлорпропионовые кислоты
,
Фторуксусная кислота
, Трифторуксусная кислота
, Три-фторнадуксусная кислота.
хлорпеларгоновая
к-ты - для получения полиамидов, нек-рые фторкислоты - для синтеза фторсодержащих
полимеров. Na-Соли ряда Г. к. - гербициды. Na-Соль цис-3-хлоракриловой
к-ты (акрофол) - дефолиант хлопчатника, Na-соль фторуксусной к-ты-инсектицид
и родентицид. См., напр., Хлоруксусные кислоты
, Xлорпропионовые кислоты
,
Фторуксусная кислота
, Трифторуксусная кислота
, Три-фторнадуксусная кислота.
Многие
Г. к. обладают раздражающим действием; ПДК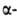 Г. к. 1-5 мг/м3,
Г. к. 1-5 мг/м3,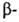 Г.
к. 5-10 мг/м3. Эфиры низших Г.к.-ла-криматоры.
Г.
к. 5-10 мг/м3. Эфиры низших Г.к.-ла-криматоры.
Лит.:Методы
элементоорганичесхой химии. Хлор. Алифатические соединения, под общ. ред.
А. Н. Несмеянова, К. А. Кочешкова, М., 1973; Общая органическая химия,
пер. с англ., т. 4, М., 1983, с. 137-55. Д. В. Иоффе.

