ГАЛОГЕНФОСФИТЫ
,
соед. общей ф-лы (RO)nPHal3_n, где R-opг.
радикал; Hal = F, Cl, Br (соед. с Hal = I обычно неустойчивы); л = 1,2.
Молекулы имеют пирамидальную форму; углы связей у Р составляют ~ 100°.
Большинство Г.-жидкости (см. табл. 1) с резким неприятным запахом; раств.
в орг. р-рителях. Имеют большой диапазон хим. сдвигов в спектрах ЯМР 31Р
(от - 110 до - 210 м.д.). Полосы поглощения в ИК-спектре (табл. 2) существенно
зависят от природы галогена.
Г.-слабые
основания. На воздухе дымят. С водой, к-тами, водными р-рами щелочей и
окислителями реагируют бурно (иногда со взрывом). Образуют комплексы с
переходными металлами. С электрофилами Г. реагируют по схеме:
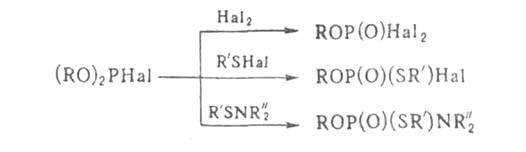
Табл 1.-СВОЙСТВА ГАЛОГЕНФОСФИТОВ
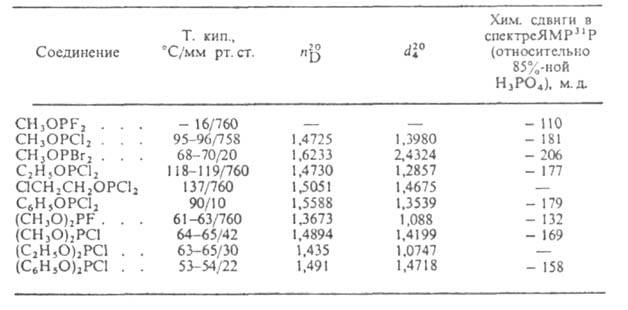
Табл.
2-ХАРАКТЕРИСТИЧНЫЕ ЧАСТОТЫ В ИК-СПЕКТРЕ ГАЛОГЕН-ФОСФИТОВ

При
взаимод. Г. с нуклеофилами образуются соед. трех-или пятивалентного Р,
напр.:
С алкил-
и ацилгалогенидами Г. вступает в р-цию Арбузова, напр.:
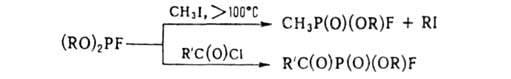
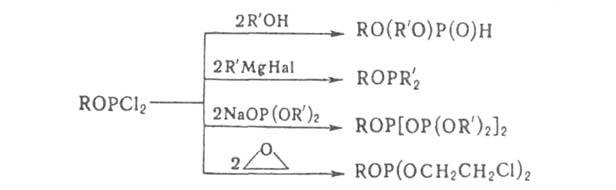
Дигалогенфосфиты
обычно получают действием спиртов или фенолов на РС13 или РВr3,
напр.:
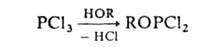
Для
введения в молекулу второй группы RO используют акцептор HHal (напр., NR3)
или применяют алкоголяты. Иногда для получения Г. удобно использовать р-цию
обмена, напр.: (С6Н5О)3Р + 2РС13
-> ЗС6Н5ОРС12. Хлор-алкилфосфиты
с высоким выходом получают действием галогенидов трехвалентного Р на эпоксиды
(оксираны).
Хлор-алкилфосфиты
с высоким выходом получают действием галогенидов трехвалентного Р на эпоксиды
(оксираны).
Г.-промежут.
продукты в синтезе фунгицидов, инсектицидов, антиоксидантов и др.
Лит.:
Пурдела Д., Вылчан у Р., Химия органических соединений фосфора, пер.
с рум., М., 1972, с. 181-85; Общая органическая химия, пер. с англ., т.
4, М.. .983. с. 670-81. Г.И. Дрозд.

