ГЕКСАФТОРАЦЕТОН
(перфторацетон)
CF3COCF3, мол. м. 166,03; бесцв. газ с резким запахом;
т. пл. — 122°С, т. кип. - 27,28°С; плотность жидкости 1,318 г/см3
(25°С);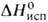 21,61 кДж/моль
( —27,28 °С); потенциал ионизации 11,68 эВ; умеренно раств. в апротонных орг.
р-рителях; реагирует с водой и спиртами; разлагается на СО и CF3 лишь
при 550 °С или УФ-облучении. Типичный представитель полифторкетонов
. В
р-циях с нуклеоф. агентами Г. гораздо активнее, чем нефториров. кетоны. Иногда
вступает в превращения, не свойственные алифатич. кетонам, в частности легко
образует устойчивые аддукты (CF3)2C(OH)X, где X = ОН,
OR, NR2. С фторидами щелочных металлов дает относительно стабильный
анион (CF3)2CFO-, широко используемый в синтезах.
Легко восстанавливается третичными аминами до (CF3)2CHOH,
реагирует с соед., содержащими активные метиленовые группы, и олефинами, напр.:
21,61 кДж/моль
( —27,28 °С); потенциал ионизации 11,68 эВ; умеренно раств. в апротонных орг.
р-рителях; реагирует с водой и спиртами; разлагается на СО и CF3 лишь
при 550 °С или УФ-облучении. Типичный представитель полифторкетонов
. В
р-циях с нуклеоф. агентами Г. гораздо активнее, чем нефториров. кетоны. Иногда
вступает в превращения, не свойственные алифатич. кетонам, в частности легко
образует устойчивые аддукты (CF3)2C(OH)X, где X = ОН,
OR, NR2. С фторидами щелочных металлов дает относительно стабильный
анион (CF3)2CFO-, широко используемый в синтезах.
Легко восстанавливается третичными аминами до (CF3)2CHOH,
реагирует с соед., содержащими активные метиленовые группы, и олефинами, напр.:
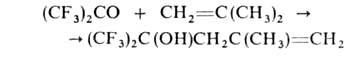
С диенами,
кетенами, алкоксиацетиленами, изонитрилами, соединениями Р(Ш) образует
продукты циклоприсоединения, напр.:
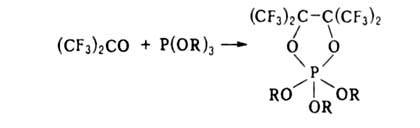
По отношению
к электроф. агентам Г. крайне пассивен: не протонируется сильными к-тами,
лишь при 100 °С взаимод. с фенолом в безводном HF, образуя гексафтордифенилолпропан.
Пром.
способ получения Г.: р-ция (СС13)2СО с HF в присут.
солей Сr(IП). Др. способы: окисление перфторизобутилена или тиогексафторацетона,
изомеризация гексафторпропиленоксида. Применяют Г. в синтезе гексафторизопропилового
спирта, фторорганических мономеров, сополимеров Г. с олефинами и их оксидами,
лекарственных средств.
Летальная
концентрация 0,09% по объему (крысы, экспозиция 30 мин).
Гексафторацетон
впервые получен Н. Фукухарой и С.Л. Бигелоу в 1941.
Гидрат
Г. (CF3)2C(OH)2-гигроскопичные белые кристаллы;
т. пл. 49°С; рКа 6,58. При действии конц. H2SO4
дает
Г., на воздухе превращ. в жидкий сесквигидрат-хороший р-ритель полимеров,
напр. полиамидов, сложных полиэфиров, полиформальдегида. ЛД50
190 мг/кг (крысы, перорально).
Лит.:
Gambaryan
N. P. [u.a.], "Angew. Chem.", 1966, Bd 78, № 22, S. 1008-17.
Н.П. Гамбарян.

