ГЕРМАНИЯ ГАЛОГЕНИДЫ
. Германий образует простые галогениды
СеНа1n(n = 1,2,4) и Ge2Hal6, смешанные
HalxGeHal4_x, оксигалогениды GeOHal2,
германогалогениды GeHxHal4_x, а также
комплексные галогениды. Св-ва простых Г. г. представлены в таблице. Их
устойчивость понижается в ряду F-Cl-Br-I. GeHaln гидролизуются
водой и влагой воздуха. GeHal4 не взаимод. с конц. H2SO4
при обычных условиях, окисляются HNO3 до GeO2. Тетрахлорид
и тетрафторид образуют хлорогерманаты и фторогерманаты М2I[ОеНа16],
MII[GeHal6] и MI[GeF5], Mn[GeF5]2.
Молекулы тетрагалогенидов имеют тетраэдрич. конфигурацию. Длина связи
(нм): Ge—C1 0,2113, Ge—F 0,1670, Ge—Вr 0,2290, Ge—I 0,2550.
СВОЙСТВА ГАЛОГЕНИДОВ ГЕРМАНИЯ
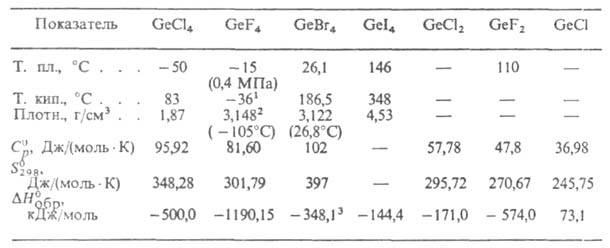
1 Т-ра возгонки. 2 Плотность жидкого 2,4 г/см3
( - 36°С). 3 Для жидкости.
Тетрахлорид GeCl4 - бесцв. жидкость;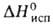 39,01 кДж/моль,
39,01 кДж/моль,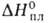 7,67 кДж/моль; ур-ние температурной зависимости давления пара над твердым
GeCl4: lgp(MM рт. ст.) = 10,77 - 2437/Г (221,4 - 186,9 К); tкрит
548,15 К, ркрит 3,69 МПа;
7,67 кДж/моль; ур-ние температурной зависимости давления пара над твердым
GeCl4: lgp(MM рт. ст.) = 10,77 - 2437/Г (221,4 - 186,9 К); tкрит
548,15 К, ркрит 3,69 МПа;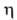 (0,599-0,516)*10-3 Па*с (293-313 К);
(0,599-0,516)*10-3 Па*с (293-313 К);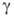 2,24-102
Н/м(303 К). Устойчив до - 1000°С. Плохо раств. в соляной к-те, причем р-римость
падает с повышением концентрации к-ты, достигая минимума (0,0494 г/л) для
40%-ной НС1. Хорошо раств. в спирте, эфире, бензоле, CS2, СНС13,
неограниченно - в жидком AsCl3. Получают GeCl4 хлорированием
Ge при 180-360 °С или взаимод. GeO2 с соляной к-той. Для получения
продукта высокой чистоты используют экстракцию соляной к-той, ректификацию,
термодиффузию, противоточную кристаллизацию и др. GeCl4 - промежут.
продукт в произ-ве Ge, GeO2, а также монокристаллов и эпитаксиальных
пленок Ge полупроводниковой чистоты.
2,24-102
Н/м(303 К). Устойчив до - 1000°С. Плохо раств. в соляной к-те, причем р-римость
падает с повышением концентрации к-ты, достигая минимума (0,0494 г/л) для
40%-ной НС1. Хорошо раств. в спирте, эфире, бензоле, CS2, СНС13,
неограниченно - в жидком AsCl3. Получают GeCl4 хлорированием
Ge при 180-360 °С или взаимод. GeO2 с соляной к-той. Для получения
продукта высокой чистоты используют экстракцию соляной к-той, ректификацию,
термодиффузию, противоточную кристаллизацию и др. GeCl4 - промежут.
продукт в произ-ве Ge, GeO2, а также монокристаллов и эпитаксиальных
пленок Ge полупроводниковой чистоты.
Тетрафторид GeF4-дымящий на воздухе бесцв. газ. При быстром
охлаждении жидким воздухом затвердевает. Твердый продукт возгоняется,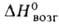 34,75 кДж/моль. Устойчив до ~ 1000 °С. Образует аддукты с SF4,
ДМСО, R3N и др. Раств. в жидком HF, образуя слабую германофтористоводородную
к-ту H2[GeF6]. Ее соли-фторогерманаты - получают
взаимод. фторида, хлорида или карбоната соответствующего металла с GeO2
в плавиковой к-те. Для Na2[GeF6] т. пл. 623 °С, для
K2[GeF6] 730 °С, для Mg[GeF6] т. разл.
465 °С. GeF4 м.б. получен разложением в вакууме Ba[GeF6]
при 700 °С, фторированием Ge, взаимод. GeO2 с BF3
или др. GeF4 - исходное или промежут. в-во при получении фторогерманатов.
34,75 кДж/моль. Устойчив до ~ 1000 °С. Образует аддукты с SF4,
ДМСО, R3N и др. Раств. в жидком HF, образуя слабую германофтористоводородную
к-ту H2[GeF6]. Ее соли-фторогерманаты - получают
взаимод. фторида, хлорида или карбоната соответствующего металла с GeO2
в плавиковой к-те. Для Na2[GeF6] т. пл. 623 °С, для
K2[GeF6] 730 °С, для Mg[GeF6] т. разл.
465 °С. GeF4 м.б. получен разложением в вакууме Ba[GeF6]
при 700 °С, фторированием Ge, взаимод. GeO2 с BF3
или др. GeF4 - исходное или промежут. в-во при получении фторогерманатов.
Тетрабромид GeBr4-дымящая во влажном воздухе бесцв. жидкость;
давление пара 213 Па (277,6 К);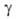 0,035 Н/м (303 К); nD20 1,6296. Раств. в спирте,
СС14, бензоле, эфире. Получают слабым нагреванием Ge в парах
брома или взаимод. GeO2 с бромистоводородной к-той. Тетрабромид-исходное
в-во для синтеза др. соед. Ge.
0,035 Н/м (303 К); nD20 1,6296. Раств. в спирте,
СС14, бензоле, эфире. Получают слабым нагреванием Ge в парах
брома или взаимод. GeO2 с бромистоводородной к-той. Тетрабромид-исходное
в-во для синтеза др. соед. Ge.
Тетраиодид GeI4-оранжево-красные кристаллы с кубич. решеткой
(а = 1,189 нм, z = 8). При 440 °С диссоциирует на Gel2
и I2. Гидролизуется на воздухе только при длит. хранении. При
нагр. восстанавливается с помощью Н2 до GeI2. Раств.
в жидком HI, GeCl4, а также бензоле, СС14 и др. орг.
р-рителях; реагирует со спиртами и ацетоном. Получают взаимод. HI с GeO2
или GeCl4, кодированием Ge. Тетраиодид м. б. исходным в-вом
для получения др. соед. Ge.
Моногалогениды GeHal (Hal = F, Cl, Br). Хлорид и фторид-твердые в-ва;
при обычных условиях их молекулы полимерны. Бромид получен только в газовой
фазе. Для GeF С°р 34,78 Дж/(моль-К), So298
233,89 Дж/(моль*К),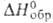 - 66,6 кДж/моль. Хлорид-темно-красное аморфное или коричневое кристаллич.
в-во; разлагается в вакууме на Ge, GeCl2 и GeCl4
(кристаллический - выше 520 °С, аморфный-при 210-300°С). Не раств. в орг.
р-рителях. Получают моногалогениды при действии электрич. разряда на соответствующий
тетрагалогенид.
- 66,6 кДж/моль. Хлорид-темно-красное аморфное или коричневое кристаллич.
в-во; разлагается в вакууме на Ge, GeCl2 и GeCl4
(кристаллический - выше 520 °С, аморфный-при 210-300°С). Не раств. в орг.
р-рителях. Получают моногалогениды при действии электрич. разряда на соответствующий
тетрагалогенид.
Дигалогениды GeHal2-кристаллы. Для GeBr2 т. пл.
144 °С, т. возг. 130°С в вакууме (для GeI2 240 °С в вакууме).
GeI2 диспропорционирует выше 440 °С, ОеВr2-выше 130°С,
GеС12-выше 75 °С с образованием соответствующего тетрагалогенида
и Ge. Дигалогениды образуются, как правило, при взаимод. Ge с соответствующим
тетрагалоге-нидом при нагр. до 300 °С.
Лит. 9М. при ст. Германий
. Н. М. Эльхонес, Л. И. Локшина.

