ГИБРИДИЗАЦИЯ АТОМНЫХ ОРБИТАЛЕЙ
, квантовохим. способ описания
перестройки орбиталей атома в молекуле по сравнению со своб. атомом. Являясь
формальным мат. приемом, Г. а. о. позволяет отразить нарушение сферич.
симметрии распределения электронной плотности атома при образовании хим.
связи. Сущность Г. а. о. состоит в том, что электрон молекулы вблизи выделенного
атомного ядра характеризуется не отдельной атомной орбиталью (АО), а линейной
комбинацией атомных орбита-лей с разл. значениями азимутального и магнитного
квантовых чисел. Такая линейная комбинация наз. гибридной (гибридизированной)
орбиталью (ГО). Как правило, гибридизация затрагивает лишь высшие и близкие
по энергии занятые АО своб. атома. Напр., для атомов элементов второго
периода периодич. системы типичная форма ГО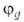 -линейная
комбинация 2s-орбитали
-линейная
комбинация 2s-орбитали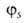 и
2р-орбиталей
и
2р-орбиталей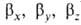
 ,
,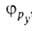
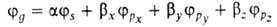 ,
,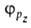 с численными коэффициентами
с численными коэффициентами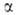 и
и
ГО обладают более низкой симметрией, чем составляющие их АО. Так, распределение
электронной плотности, отвечающее указанной ГО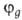 ,
смещено от атомного ядра в направлении вектора п с координатами
,
смещено от атомного ядра в направлении вектора п с координатами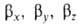 ; вектор п является осью симметрии ГО (рис. 1). При изменении ориентации
в пространстве осей координат коэффициенты линейной комбинации могут изменяться,
однако остается постоянным отношение сумм квадратов коэффициентов для данного
значения азимутального квантового числа. Это отношение определяет тип ГО.
Напр., орбиталь
; вектор п является осью симметрии ГО (рис. 1). При изменении ориентации
в пространстве осей координат коэффициенты линейной комбинации могут изменяться,
однако остается постоянным отношение сумм квадратов коэффициентов для данного
значения азимутального квантового числа. Это отношение определяет тип ГО.
Напр., орбиталь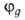 относится
к типу sapb, где а и b- числа,
подобранные так, чтобы
относится
к типу sapb, где а и b- числа,
подобранные так, чтобы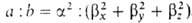 .
Обычно принимают а — 1, b = 1, 2 или 3.
.
Обычно принимают а — 1, b = 1, 2 или 3.
Как правило, гибридные орбитали данного атома в молекуле относятся к
одному типу, к-рый называют типом гибридизации атома. Так, атом N в молекуле
аммиака имеет Г. а. о. типа sp3, атом С в молекуле этилена -
sp2-гибридизацию, атом С в молекуле ацетилена - sp-гибридизацию.
Это дает основание отождествлять тип гибридизации атома в молекуле с символом
его некоей гипотетич. электронной конфигурации.
Обычно система ГО строится таким образом, чтобы для разных орбиталей
одного атома интегралы перекрывания были равны нулю (см. Молекулярные интегралы
). Кроме того, каждая орбиталь в молекуле либо остается негибридизированной
АО, либо выбирается гибридизированной по определенному типу. Этим требованиям
удовлетворяют неск. наборов орбиталей. Напр., атом О в молекуле Н2О
можно считать как sp2-, так и 5р3-гибридизированным.
Оси симметрии всех орбиталей обычно образуют симметричную фигуру (см. рис.
2). Операции симметрии этой фигуры переводят ГО одного атома друг в друга.
Такие ГО наз. эквивалентными. Напр., линейная комбинация четырех валентных
АО атома С приводит к четырем 5р3-гибридным орбиталям, оси симметрии
к-рых по отношению друг к другу расположены под углом 109,5°, т.е. направлены
по углам тетраэдра (рис. 2, в).
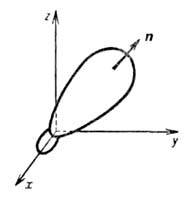
Рис. 1. Гибридная орбиталь, образованная из 2s- и 2р-атомных орбиталей;
х, у, z- координатные оси, п-ось симметрии.
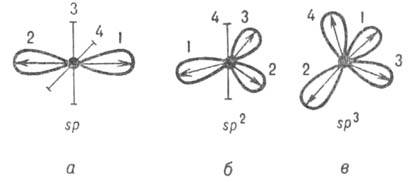
Рис. 2. Система гибридных орбиталей 5р"-типа (1, 2, 3, 4); о, б,
в соответствуют п = 1, 2, 3. Оси симметрии негибридизированных атомных орбиталей изображены отрезками. Стрелками указано направление смещения электронной плотности.
Представление о Г. а. о. используется для изучения закономерностей изменения
электронной плотности молекулы вблизи к.-л. атомного ядра в зависимости
от его окружения, т.е. позволяет установить связь между электронным строением
молекулы и ее структурой. При этом возможны разл. подходы к анализу этой
связи. Если известно геом. расположение атомных ядер, расчет волновой ф-ции
молекулы можно свести к изучению парных взаимод. соседних атомов (см. Валентных связей метод
, Молекулярных орбиталей методы
). Для такого расчета выбирают
одну из возможных систем ГО и располагают ее в пространстве так, чтобы
обеспечить макс. перекрывание отдельных пар ГО разных атомов. Другой подход
применяется в неэмпирических методах
квантовой химии, в к-рых все
взаимод. атомов в молекуле учитываются одновременно и волновая ф-ция молекулы
не зависит от того, атомные или гибридизированные орбитали используются
для расчета. В этом случае ГО строят после определения волновой ф-ции молекулы
таким образом, чтобы в отдельных областях пространства распределение электронной
плотности можно было описать одной ГО. В обоих подходах тип Г. а. о. обусловлен
геом. конфигурацией молекулы и для большинства равновесных конфигураций
оба подхода приводят к близким формам ГО.
В теоретич. химии для систематизации эксперимент. данных о равновесных
конфигурациях молекул часто применяют феноменологич. подход, в рамках к-рого
атомы данного элемента склонны к гибридизации определенного типа, а тип
гибридизации определяет взаимное расположение ядер ближайшего окружения.
Отклонение конфигурации молекулы от симметричной связывают с взаимод. хим.
связей (напр., с отталкиванием пар электронов, образующих связь). В такой
форме представления о Г. а. о. используются в стереохимии.
Понятие о Г. а. о. введено в химию Л. Полингом в 1931.
Лит.: Гиллеспи Р., Геометрия молекул, пер. с англ., М., 1975;
Минкин В. И., Симкин Б. Я., Миняев Р. М., Теория строения молекул, М.,
1979. В. И. Пупышев.

