ГИДРАЗИНА ЗАМЕЩЕННЫЕ ОРГАНИЧЕСКИЕ
, содержат до четырех орг.
остатков в молекуле гидразина (Г.). Различают: 1) монозамещенные, сим-
и несим-дизамещенные, три- и тетразамещенные Г., содержащие алифатич.
(алкилгидразины), ароматич. (арилгидразины) или гетероциклич. остатки в
Г.; сим-дизамещенные Г. наз. также гидразосоединениями, напр. гидразобензол
(см. табл.); 2) гидразиды - моно- и диацилзамещенные Г., соотв. первичные
RCONHNH2 и вторичные RCONHNHCOR; 3) гидразоны и азины-
производные
Г. соотв. с одной и двумя молекулами альдегида или кетона RRC=NNH2
и RRC—NN= =CRR (где R-Alk, Ar; R = H, Alk, Ar). См. также Гидразиды арилсулъфокислот.
СВОЙСТВА АЛКИЛ- И АРИЛЗАМЕЩЕННЫХ ГИДРАЗИНОВ
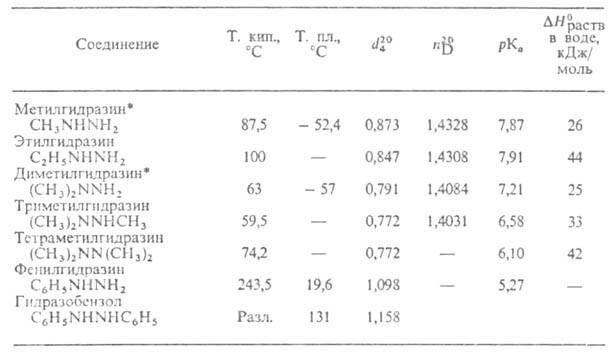
* Значения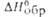 (в кДж/моль) и вязкости
(в кДж/моль) и вязкости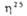 (в мПа*с) для метил-и несим-диметилгидразинов составляют соотв. -53 и 0,893,
—53,5 и 0,51.
(в мПа*с) для метил-и несим-диметилгидразинов составляют соотв. -53 и 0,893,
—53,5 и 0,51.
Низшие алкилгидразины (до С11)-гигроскопичные, дымящие на
воздухе, весьма агрессивные (разъедают кожу, каучук, отчасти даже стекло)
жидкости со специфич. запахом; раств. в спирте, эфире и воде (с разогреванием).
Высшие — кристаллич. в-ва. Колебательные и ЯМР-спектры низших алкилгидразинов
свидетельствуют о наличии межмолекулярной ассоциации с большей энергией
(8-10 кДж/моль), чем в Г. В масс-спектрах всех алкилгидразинов надежно
регистрируются молекулярные ионы, к-рые благодаря делокализации положит,
заряда между обоими атомами N распадаются в дальнейшем не по связи N—N,
а по связям СС или CN. Моно- и диалкилгидразины - основания той же силы, что и Г.;
три- и тетраалкилгидразины значительно менее основны. С к-тами алкилгидразины
образуют кислые и нейтральные соли. Хорошо кристаллизуются обычно гидросульфаты,
оксалаты, пикраты. Гидрохлориды низших моноалкилгидразинов весьма гигроскопичны
и не имеют четких т-р плавления, а гидрохлориды аралкилгидразинов кристаллизуются
легко.
СС или CN. Моно- и диалкилгидразины - основания той же силы, что и Г.;
три- и тетраалкилгидразины значительно менее основны. С к-тами алкилгидразины
образуют кислые и нейтральные соли. Хорошо кристаллизуются обычно гидросульфаты,
оксалаты, пикраты. Гидрохлориды низших моноалкилгидразинов весьма гигроскопичны
и не имеют четких т-р плавления, а гидрохлориды аралкилгидразинов кристаллизуются
легко.
Моноарил- и несим-диарилгидразины-кристаллич. в-ва или вязкие жидкости,
разлагающиеся вблизи своих т-р кипения; слабые основания. сим-Диарилгидразины,
напр. гидразобензол, и триарилгидразины солей с к-тами не образуют, но
в их присут. претерпевают скелетные перегруппировки -бензидиновую и семидиновую,
приводящие к промежут. продуктам для синтеза красителей и лек. ср-в.
Большинство гидразонов и первичные гидразиды (напр., гидразид уксусной
к-ты; т. пл. 67 °С)-твердые в-ва; слабые основания, образуют соли только
с сильными минер. к-тами. Вторичные гидразиды образуют соли со щелочами.
Г. з. о.-сильные восстановители. Атмосферный кислород медленно окисляет
их уже при комнатной т-ре; на сильно развитых поверхностях они могут само
воспламеняться. Тетраметилгидразин более устойчив к окислению, чем др.
метилгидразины. Качеств. определение Г. з.о. основано на восстановлении
солей Си (реактив Фелинга) или Ag2O; для их количеств. определения
используются иодо- или иодатометрия, вольтамперометрия и др. Моноалкил(или
арил)гидразины окисляются по схеме: RNHNH2 RH
+ N2 + + Н2О; окисление сим-
и несим-диалкилгидразинов
приводит соотв. к азоалканам и тетразенам (через промежуточные аминонитрены):
RH
+ N2 + + Н2О; окисление сим-
и несим-диалкилгидразинов
приводит соотв. к азоалканам и тетразенам (через промежуточные аминонитрены):
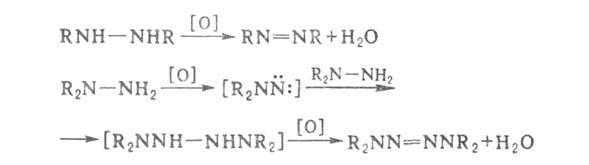
сим-Диарилгидразины очень легко окисляются, особенно в щелочных средах.
Так, при автоокислении гидразобензола в спирте образуется азобензол и Н2О2,
а при его окислит.-восстановит. диспропорционировании при повыш. т-рах-азобензол
и анилин. Три- и тетраарилгидразины -весьма слабые восстановители. Окисление
гидразида 3-аминонафталевой к-ты (люминола) в щелочной среде сопровождается
интенсивным голубым свечением; это св-во характерно для нек-рых др. сходно
построенных гидразидов.
Действием HNO2 на алкил- или арилгидразины получают их нитрозопроизводные,
к-рые м. б. превращены в амины или азиды:
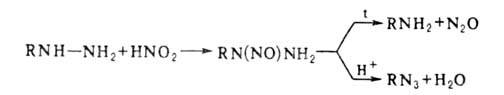
Гидразиды взаимод. с HNO2, образуя азиды, из к-рых м. б.
получены амины (р-ция Курциуса); последовательность этих р-ций-удобный
способ перехода от карбоновых к-т к аминам.
Алкилгидразоны весьма реакционноспособны: гидролизуются в кислых средах
на алкилгидразины и карбонильные соед., с алкилгидразинами вступают в р-цию
обмена (перегидразинирование):
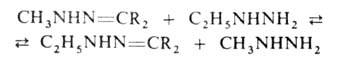
Арилгидразоны в кислых средах претерпевают термич. перегруппировку (р-ция
Фишера), приводящую к производным индола:
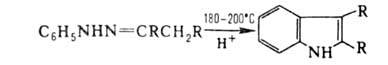
Незамещенные гидразоны (не содержат орг. заместителей в группе NH2)
в присут. щелочей разлагаются с образованием углеводородов (р-ция Кижнера-Вольфа):
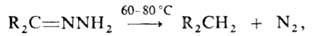
что является удобным способом восстановления карбонильных соединений.
Р-ции алкил- и арилгидразинов, протекающие с участием обоих атомов N,
приводят к разл. гетероциклич. соединениям. Так, из фенилгидразина и ацетоуксусного
эфира получают 1-фенил-З-метилпиразолон-промежут. продукт в синтезе жаропонижающих
лек. ср-в и красителей. Конденсация моноалкилгидразинов с 1,3-дикетонами
приводит к производным пиразола:
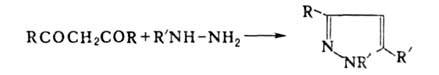
С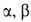 -ненасыщенными
альдегидами и кстонами образуются производные пиразолина, с диациламинами
- производные 1,2,4-триазола, напр.:
-ненасыщенными
альдегидами и кстонами образуются производные пиразолина, с диациламинами
- производные 1,2,4-триазола, напр.:
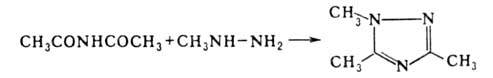
Наиб. общий способ получения Г.з.о.-замещение (алки-лирование, ацилирование,
конденсация с карбонильными соед.) одного или неск. атомов Н в молекуле
Г. Так получают (в избытке Г.) нек-рые моноалкил-, аллил-, пропаргил-,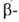 оксиэтил-
и др. функционально замещенные алкилгидразины, а также гидразоны и гидразиды
к-т. Алкилирование Г. приводит сначала к монозамещенному продукту, к-рый,
однако, легко превращается в несим-диалкилгидразин. сим-Диалкилгидразины
синтезируют из вторичных гидразидов муравьиной к-ты по схеме:
оксиэтил-
и др. функционально замещенные алкилгидразины, а также гидразоны и гидразиды
к-т. Алкилирование Г. приводит сначала к монозамещенному продукту, к-рый,
однако, легко превращается в несим-диалкилгидразин. сим-Диалкилгидразины
синтезируют из вторичных гидразидов муравьиной к-ты по схеме:
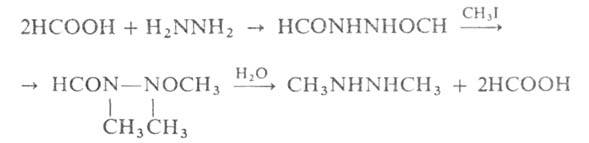
При алкилировании несим-диалкилгидразинов образуются четвертичные гидразиниевые
соли, напр.
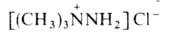
Производные, замещенные при одном атоме N, получают исходя из
аминов (р-ция Рашига):
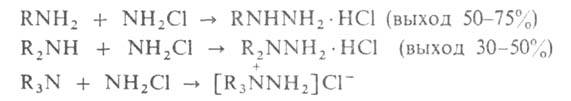
Метилгидразин образуется также при термолизе низших гидразиноспиртов
(выход 30%), напр.:
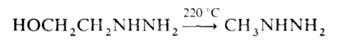
Моноалкилгидразины удобно получать каталитич. гидрированием гидразонов
кетонов:
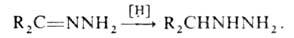
Азины тем же путем м. б. превращены в сим-диалкил(арил)гидразины, а
метилированием с послед. гидролизом - в метилгидразин, напр.:
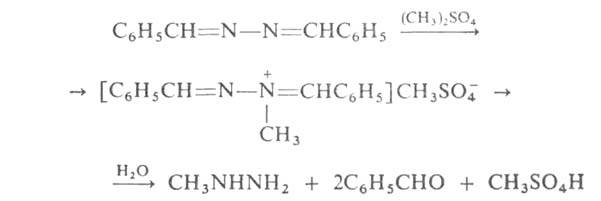
Гидразиды восстанавливаются труднее гидразонов, поэтому возможно селективное
гидрирование ацилгидразонов с сохранением ацильной группы:
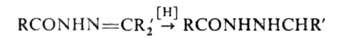
Моно- и дизамещенные гидразины синтезируют также через диазиридины,
легко получаемые из оснований Шиффа и хлорамина (способ Бергбау - Бауэра)
или непосредственно из подходящего кётона [кетона], амина и газообразного хлора,
напр.:
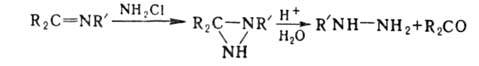
Арилгидразины, за исключением 2,4-динитрофенилгидразина, не м. б. получены
взаимод. Г. с арилгалогенидами. Фенилгидразин получают осторожным восстановлением
(обычно Na2SO3) фенилдиазониевых солей:
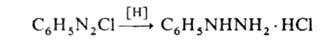
сим-Диарилгидразины синтезируют действием слабых восстановителей на
азосоединения или нитробензолы:
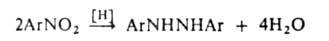
Несимметричные диалкил- и диарилгидразины получают также гидрированием
(кат.-Pt или Ni) нитрозаминов:
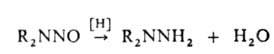
Многотоннажное пром. произ-во несим-диметилгидразина базируется на этом
методе.
сим-Гидразоизобутиронитрил [(CH3)2C(CN)NH]2
получают из ацетона, сульфата Г. и NaCN; окисление его хлором приводит
к 2,2-азо-бис-изобутиронитрилу.
Тетрафенилгидразин синтезируют окислением дифениламина: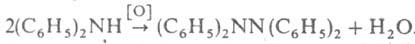 . При обработке несим-дифенилгидразина пикрилхлоридом получают трехзамещенный
гидразин, к-рый при окислении РbО2 в хлороформе превращается
в устойчивый своб. радикал -дифенилпикрилгидразил:
. При обработке несим-дифенилгидразина пикрилхлоридом получают трехзамещенный
гидразин, к-рый при окислении РbО2 в хлороформе превращается
в устойчивый своб. радикал -дифенилпикрилгидразил:
Гидразоны легко получают конденсацией Г., моно- или несим-дизамещенных
гидразинов с альдегидами и кетонами, напр.: С6Н5СНО
+ H2NNH2 -> C6H5CH=NNH2
+ Н2О. Незамещенные гидразоны могут конденсироваться еще с одной
молекулой карбонильного соед., превращаясь в азины, напр.:
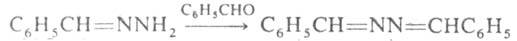 (т. пл.
(т. пл.
93 °С). Гидразоны моноалкил(или арил)гидразинов при конденсации с карбонильными
соед. образуют циклич. и полимерные продукты. Р-цию гидразинов (гл. обр.
фенил-, 2,4-динитрофенилгидразинов и семикарбазида) с альдегидами и кетонами
используют для их идентификации; она нашла применение также в синтезе гетероциклов
и алкилгидразинов.
Гидразиды к-т получают аналогично амидам действием Г. на карбоновые
к-ты, их эфиры, ангидриды или амиды, напр.: H2NNH2
+ RCOOR -> RCONHNH2 + ROH
Они м. б. получены также из алкилмочевин (р-ция Гофмана), взаимод. Г.
с изоцианатами или восстановлением ацилнитрамидов. В отличие от алкилирования
гидразинов, направленного исключительно на уже замещенный атом N, анилирование
(напр., по р-ции Шоттена-Баумана) не обладает такой селективностью и в
жестких условиях можно получить гидразиды моноалкилгидразинов, замещенные
по NH и NН2-группам (вторичные).
Г. з. о. применяют в синтезе лек. в-в (напр., гидразид изоникотиновой
к-ты и родственные ему соед.), красителей, оптич. отбеливателей, инициаторов
полимеризации и порообразователей (напр., гидразиды бензол- и n-толуолсульфокислот,
1,3,5-тригидразино-сим-триазин, 2,2-азо-бис-изобутиронитрил). несим-Диметилгидразин-одно
из важнейших ракетных топлив (см. Диметилгидразины
).
Низшие алкилгидразины весьма токсичны. Так, метилгидразин уже в концентрации
0,01% убивает бактерии и грибки. В виде жидкостей или паров они сильно
раздражают кожу и дыхат. пути; часто наблюдается сенсибилизация к веществу
(особенно к фенилгидразину). Поскольку они хорошо резорбируются кожей возможно
и общее отравление. ПДК низших алкилгидраэинов 0,1 мг/л в расчете на N2H4.
Лит.: Овербергер Ч.Д., АнселмЖ.П., Ломбардино Д.Г., Органические соединения
со связями азот-азот, пер. с англ., Л., 1970; Китаев Ю. П., Б у зыкин Б.
И., Гидразоны, М., 1974; Химия гидразонов, М., 1977; Иоффе Б. В., Кузнецов
М. А., Потех и н А. А., Химия органических производных гидразина, Л., 1979;
Общая органическая химия, пер. с англ., М., 1982, т. 3, с. 262-300, т.
4, 1983, с. 509-524; Ullmanns Encyklopadie, 4 Aufl., Bd 13, Weinheim, 1977;
Kirk-Othmer encyclopedia, 2 cd., v. II, N.Y., 1966. П.А. Гембицкий.
В. А. Лунин.

