ГИЛЛЕСПИ ТЕОРИЯ
, система постулатов и правил для объяснения и
предсказания геом. конфигурации молекул на основе принципа Паули и модели
отталкивания электронных пар валентных орбиталей. Согласно Г.т., пространственная
направленность хим. связей поливалентного атома в молекуле зависит прежде
всего от общего числа электронов в его валентной оболочке. Электронные
облака связывающих атомы электронных пар и электронов на несвязывающих
орбиталях (т.е. неподеленных пар валентной оболочки атомов) грубо представляются
в виде жестких сфер соотв. меньшего и большего диаметров. Атомный остов,
включающий ядро и внутр. электронные оболочки, также считается сферическим
(с нек-рыми исключениями). Сферич. облака электронных пар окружают остов
так, что их взаимное отталкивание минимально, т.е. они максимально удалены
друг от друга. Такая модель позволяет оценивать валентные углы в молекулах.
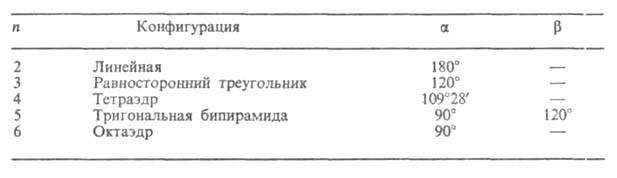
Идеальные конфигурации и значения валентных углов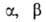 для молекул с числом п сфер одинакового диаметра приведены в таблице.
для молекул с числом п сфер одинакового диаметра приведены в таблице.
ТИПЫ КОНФИГУРАЦИЙ МОЛЕКУЛ
При разл. диаметрах сфер (связывающих и неподеленных пар электронов)
образуются искаженные конфигурации с валентными углами, отличающимися от
их идеальных значений. Напр., в молекулах СН4, NH3
и Н2О в валентных оболочках атомов С, N и О находятся четыре
электронные пары, но для СН4 они все связывающие, а у атомов
азота и кислорода имеются соотв. одна и две неподеленные электронные пары.
Поэтому идеальную тетраэдрич. конфигурацию имеет лишь молекула СН4;
в молекулах NH3 и Н2О валентные углы меньше тетраэдрического.
Оценка радиусов электронных сфер и атомных остовов с использованием значений
ковалентных и ионных радиусов атомов, а также постулатов Г. т., касающихся
кратных, полярных связей и др., позволяет судить и о длинах связей в молекулах.
Г.т. дает результаты качеств. или полуколичеств. характера и применяется
гл. обр. в химии неорг. и координац. соединений. Теория полезна также при
рассмотрении фрагментов цепных, слоистых и объемных кристаллич. структур.
Осн. положения теории сформулировали Р. Найхолм и Р. Гиллеспи в 1957.
Лит.: Гиллеспи Р., Геометрия молекул, пер. с англ., М., 1975;
Минкин В. И., Симкин Б. Я., Миняев Р. М., Теория строения молекул, М.,
1979. Ю. А. Пентин.

