ГЛИКОЗИДЫ
(от греч. glykys-сладкий и eidos-вид), соед., в к-рых
остаток циклич. формы моно- или олигосахарида (гликозильный, или углеводный,
остаток) связан с др. орг. остатком (агликоном) через гетероатом; соотв.
различают О-, N-, S-гликозиды и др. Связь между гликозильным остатком и
агликоном наз. гликозидной.
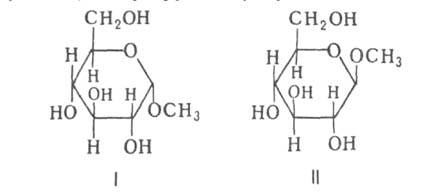
При образовании Г. возникает новый асимметрич. гликозидный центр. Его
конфигурацию обозначают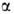 или
или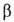 в зависимости от того, совпадает она или нет с конфигурацией того углеродного
атома моносахарида, к-рый определяет принадлежность последнего к D- или
L-ряду. Напр., в изомерных метил-О-глюкопиранозидах конфигурация
в зависимости от того, совпадает она или нет с конфигурацией того углеродного
атома моносахарида, к-рый определяет принадлежность последнего к D- или
L-ряду. Напр., в изомерных метил-О-глюкопиранозидах конфигурация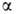 отражается ф-лой I, конфигурация
отражается ф-лой I, конфигурация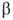 -ф-лой
II:
-ф-лой
II:
По размеру цикла углеводного остатка Г. делят на фуранозиды (5-членные),
пиранозиды (6-) и септанозиды. (7-); по числу моносахаридных остатков в
углеводной части молекулы - на моноозиды, биозиды, триозиды и олигозиды
(соотв. производные моно-, ди-, три- и олигосахаридов).
Присоединение гликозильного остатка к агликону (гликозилирование) повышает
гидрофильность соединения, что играет важную роль в метаболизме. Мн. углеводные
остатки, особенно олигосахаридные, выполняют ф-ции специфич. маркеров пов-стей
клеток и биополимеров, обусловливающих их узнавание др. клетками.
К О-гликозидам в широком смысле слова относят не только Г. с неуглеводными
агликонами, но и внутр. ангидриды Сахаров (внутр. Г.), олиго- и полисахариды.
О-Г.-малолетучие кристаллич. или аморфные в-ва. Г. низших спиртов легко
раств. в воде, спиртах, не раств. в малополярных орг. р-рителях. Р-римость
Г. со сложными агликонами в значит. мере определяется хим. особенностями
последнего: соед. с полярными агликонами (напр., Г. полиолов) раств. в
воде, соед. с крупными гидрофобными агликонами не раств. в воде и малополярных
р-рителях. Для олигозидов с большими малополярными агликонами (напр., сапонины)
характерны пенообразующие св-ва.
Г. не обладают хим. св-вами восстанавливающих Сахаров, обусловленными
карбонильной группой, не подвержены мутаротации. Они легко ацилируются
ангидридами и галоген-ангидридами к-т в пиридине с образованием сложных
эфиров, алкилируются типичными алкилирующими агентами в сильнощелочных
средах, образуют циклич. ацетали и кетали при конденсации с карбонильными
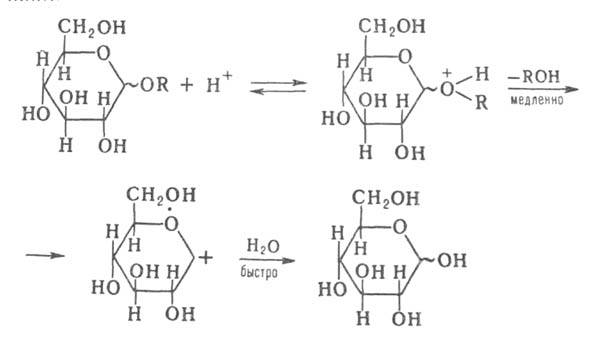
соед., окисляются периодатами с расщеплением связей С—С, подвергаются кислотному
гидролизу, алкоголизу, формолизу с расщеплением гликозидной связи. Скорость
гидролиза в Наиб. степени зависит от размера цикла: фуранозиды гидролизуются
на два порядка быстрее пиранозидов. Механизм гидролиза м. б. представлен
след. схемой (знак ~ означает, что молекула Г. может иметь или
или конфигурацию):
конфигурацию):
Скорость ферментативного гидролиза, к-рый осуществляется под действием
гликозидгидролаз, зависит от структуры агликона.
Г. с алифатич. и алициклич. агликонами устойчивы к действию р-ров щелочей,
с ароматич. и нек-рыми гетероциклич. агликонами - неустойчивы. Так, щелочное
расщепление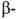 D-глюкопиранозидов
с ароматич. агликоном дает 1,6-ангидроглюкозу (левоглюкозан), что является
препаративным методом синтеза последней.
D-глюкопиранозидов
с ароматич. агликоном дает 1,6-ангидроглюкозу (левоглюкозан), что является
препаративным методом синтеза последней.
Методы синтеза Г. основаны на нуклеоф. замещении при гликозидном центре
восстанавливающих Сахаров и их производных. Кислотный алкоголиз Сахаров
в избытке спирта приводит к смеси четырех изомерных Г. (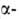 и
и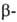 пиранозидов,
пиранозидов,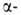 и
и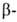 фуранозидов),
где в состоянии равновесия преобладают пиранозиды. Конкретный состав смеси
зависит от конфигурации углевода. Для стерео- и региоселективного синтеза
Г. с определенной конфигурацией гликозидного центра и размером цикла применяют
гликозилирование агликонов производными углеводов с активированным гликозидным
центром и полностью защищенными спиртовыми гидроксилами.
фуранозидов),
где в состоянии равновесия преобладают пиранозиды. Конкретный состав смеси
зависит от конфигурации углевода. Для стерео- и региоселективного синтеза
Г. с определенной конфигурацией гликозидного центра и размером цикла применяют
гликозилирование агликонов производными углеводов с активированным гликозидным
центром и полностью защищенными спиртовыми гидроксилами.
В кач-ве гликозилирующих агентов чаще всего используют: ацилгликозилгалогениды
(напр., ф-лы III), бензилгли-козилгалогениды, 5-членные циклич. ортоэфиры
(напр., IV), производные пирувонитрила (напр., V), оксазолиновые производные
(напр., VI).
Для синтеза арил-О-Г. применяют также сплавление полных ацетатов восстанавливающих
Сахаров с фенолами в присут. сильнокислых катализаторов (метод Гельфериха).
Прир. О-Г. выделяют гл. обр. из растений.
К прир. О-Г. относятся сапонины, гликозиды сердечные
, флавоноидные
коферменты (напр., рутин), гликолипиды, гликопротеины, нек-рые антибиотики.
Хим. св-ва N-гликозидов сильно зависят от характера заместителей при
атоме N. Алифатич. и ароматич. N-Г., содержащие при N атом водорода, подвергаются
мутаротации (подобно восстанавливающим сахарам) вследствие таутомерного
превращения в форму шиффовых оснований, напр.:
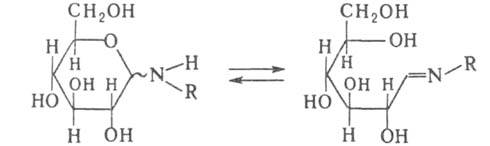
Они легко подвергаются кислотному и щелочному гидролизу.
N-Гликозиламиды, в т.ч. N-гликозилмочевины, и соед., в к-рых гликозидный
атом N включен в амидную структуру, не склонны к мутаротации и по устойчивости
к гидролизу сходны с О-Г. Алифатич. и ароматич. Г., в к-рых гликозидный
атом N обладает достаточно высокой основностью, подвергаются перегруппировке
в 1-амино-1-дезоксикетозы (Амадори перегруппировка
).
Алифатич. и ароматич. N-Г. получают конденсацией восстанавливающих Сахаров
с аминами; N-гликозиламиды и гликопептиды - восстановлением гликозилазидов
с послед. N-ацилированием; нуклеозиды и их структурные аналоги-N-гликозилированием
азотсодержащих гетероциклич. соединений ацилгликозилгалогенидами и их аналогами.
К прир. N-Г. относятся нуклеозиды, нуклеотиды, нуклеиновые к-ты, гликопротеины,
нек-рые смешанные биополимеры, в к-рых гликозидная связь соединяет углеводные
и пептидные цепи через амидный атом N остатка аспарагина. Многие N-Г. и
структурные аналоги нуклеозидов, являясь антиметаболитами нуклеозидов,
обнаруживают высокую физиол. активность и используются в кач-ве лек. препаратов,
напр. фторафур, цитарабин.
Для S-гликозидов характерны специфич. св-ва, связанные с возможностью
окислит.-восстановит. р-ций по атому S. К ним относятся гидрогенолиз над
никелем Ренея, окислит. расщепление галогенами, окисление до сульфонов,
образование из S-Г. гликозилгалогенидов. Гидролиз S-Г. в отличие от гидролиза
О-Г. может протекать в мягких условиях в присут. солей Hg и Cd, что позволяет
вести селективную р-цию, не затрагивая О-гликозидные связи молекулы. S-Г.,
аналогично ароматич. О-Г., получают конденсацией тиолятов щелочных металлов
с ацилгликозилгалогенидами. Специфич. методы - конденсация ацилгликозилгалогенидов
с тиомочевиной с послед. гидролизом тиурониевой соли и частичный гидролиз
диалкилдитиоацеталей Сахаров, катализируемый солями Hg.
Лит.: Химия углеводов, М., 1967; Бочков А. Ф., Афанасьев В. А.,
Заи-ков Г. Е., Образование и расщепление гликозидных связей, М., 1978;
Bochkov A. F., Zaikov G. Е., Chemistry of the O-glycosidic bond: formation
and cleavage. Oxf.-N.Y., 1979. А.Ф. Бочков.

