ГЛУТАТИОНРЕДУКТАЗА
[НАД(Ф)Н : окисленный глутатион оксидоредуктаза],
фермент класса оксидоредуктаз, катализирующий восстановление окисленного
глутатиона, напр.: ГS—SГ + НАДФН + Н+ -> 2ГSН + НАДФ, где Г8-оста
ток глутатиона, НАДФН и НАДФ-соотв. восстановленная и окисленная формы
кофермецта никотинамидадениндинуклеотидфосфата. Вместо НАДФН в р-ции может
также участвовать восстановленный никотинамидадениндинуклеотид (НАДН).
Г. обладает высокой специфичностью к глутатиону. С очень низкой скоростью
может катализировать восстановление др. дисульфидов. В присут. 2,4,6-тринитробензолсульфокислоты
проявляет заметную оксидазную активность.
Г. состоит из 2 одинаковых субъединиц (мол. масса каждой 50-55 тыс.),
полость между к-рыми в ходе р-ции занимает окисленный глутатион. Субъединицы
содержат по 4 структурных домена. На одном конце каждой из них расположен
остаток коферментной формы рибофлавина — флавинадениндинуклеотида, на другом
- НАД (Ф) Н-связывающие участки. наиб. изучена Г. из эритроцитов человека
(мол. м. 103278), субъединица к-рой состоит из 478 аминокислотных остатков
и содержит по 30%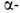 спиралей
и
спиралей
и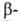 структур.
структур.
Г. выделена из источников животного, растительного и микробного происхождения.
Ее физиол. роль до конца не выяснена. Активность Г. в сыворотке крови повышается
при инфаркте миокарда, онкологич. заболеваниях и гепатитах, а в эритроцитах
- при наследств. недостаточности фермента глюкозо-6-фос фатдегидрогеназы,
что позволяет использовать Г. в диагностич. целях.
Лит.: Flo he L., Gunzler W. А., в кн.: Glutathione. Metabolism
and function, ed. by I.M. Arias, W.B. Jakoby, N.Y., 1976, p. 17-34;
Krawth-SiegelR.L. [a.o.], "Europ. J. Biochem.", 1982, v. 121, № 2, p. 259-74;
Pai E.F., Schulz G.E., "J. Biol. Chem.", 1983, v. 258, № 3, p. 1752-57.
H.H. Чернов
.

