ГОМБЕРГА - БАХМАНА - ХЁЯ РЕАКЦИЯ
(Гомберга
-Бахмана р-ция, Гомберга р-ция), синтез несимметрич. диа-рилов арилированием
ароматич. соед. диазосоединениями или N-нитрозоацетиламинами:
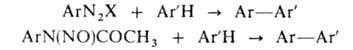
В кач-ве диазосоединения применяют соли диазония (X = С1, Вr), диазогидроксиды
(X = ОН), диазоацетаты (X = ОСОСН3) или диазоаминосоединения
(X = NR2). При наличии заместителей в бензольном кольце арилирование
всегда идет в орто-
или пара-положение, причем скорость р-ции возрастает
в ряду: O2NC6H5 > С1С6Н5
> ВrС6Н5 > > СН3С6Н5
> С6Н6. При использовании диазоацетатов процесс осуществляют
обычно в водном р-ре NaOH или CH3COONa при охлаждении. В среде
пиридина р-ция протекает в отсутствие щелочи при 20-70°С. Р-цию с диазоаминосоединениями
проводят в орг. р-рителе в присут. ледяной СН3СООН или сухого
НС1 при 60-140 °С. При применении N-нитрозоацетиламинов их раств. в ароматич.
компоненте при 20-40 °С. Твердые ароматич. соед. арилируют в среде СНС13
или СС14. Выход диарилов при использовании N-нитрозоацетиламинов
составляет ок. 50%, в остальных случаях 10-20%. Осн. побочная р-ция - образование
линейных полиарилов.
Механизм реакции включает образование свободных радикалов:
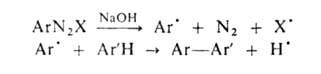
Подобным образом, как в Г.-Б.-X. р., происходит арилирование гетероциклич.
соединений. В случае тиофена образуется смесь 2- и 3-арилтиофенов; арилирование
фурана протекает региоспецифично в положение 2.
Р-цию используют для получения терфенилов и монозамещенных дифенилов.
Она открыта М. Гомбергом и В. Бахманом в 1924, позднее исследовалась Д.
Хеем и У. Гривом, предложившими применять N-нитрозоацетиламины и использовать
CH3COONa вместо NaOH.
Лит.: Бах манн В. Е., Гофманн Р. А., в сб.: Органические реакции,
пер. с англ., сб. 2, М., 1950, с. 244-84; Де-Tnp Д. Л., там же, сб. 9,
М., 1959, с. 529-600; Девис Д. И.. Перрет М. Дж., Свободные радикалы в
органическом синтезе, nepv с англ., М., 1980, с. 41-48.
Г. Л. Мищенко.

