ГОФМАНА - ЛЁФЛЕРА РЕАКЦИЯ
(перегруппировка Гофмана - Лёфлера [Лефлера],
р-ция Гофмана- Л ёфлера [ефлера] - Фрайтага), циклизация N-галогенаминов в замещенные
пирролидины при нагр. в сильной к-те с послед. действием щелочи на промежуточно
образующиеся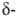 галогенамины,
напр.:
галогенамины,
напр.:
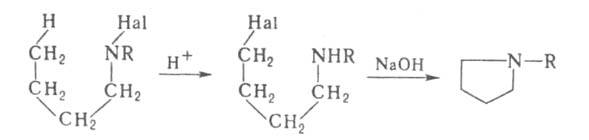
где Hal = С1, Вг. Процесс обычно проводят при т-ре 90-140 °С в H2SO4
или CF3COOH. Р-ция инициируется также облучением УФ-светом или
ионами Fe2+ ; ингибируется кислородом. наиб. высокие выходы
(до 80%) достигаются при использовании N-хлораминов. N-Галогенамиды в условиях
Г.-Л. р. превращ. в пирролидины с потерей ацильной группы. Из N-хлор-L-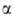 -аминокислот
получаются оптически чистые L-пролины.
-аминокислот
получаются оптически чистые L-пролины.
Конкурирующий процесс в Г.-Л. р.-циклизация с участием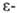 углеродного
атома, приводящая к производным пиперидина, причем при благоприятных конформационных
факторах такой путь может стать преобладающим. Это наблюдается, в частности,
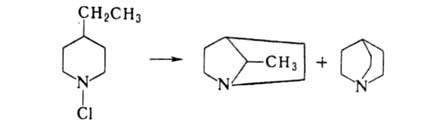
при образовании мостиковых соед., напр.:
углеродного
атома, приводящая к производным пиперидина, причем при благоприятных конформационных
факторах такой путь может стать преобладающим. Это наблюдается, в частности,
при образовании мостиковых соед., напр.:
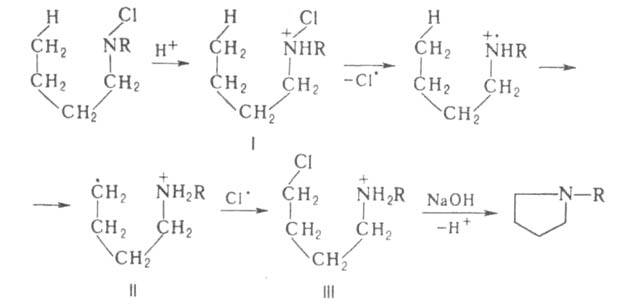
Механизм Г.-Л. р. включает гомолиз протонированного N-галогенамина (ф-ла
I) и взаимод. соед. II с соед. I с образованием галогенамина
III:
галогенамина
III:
Г.-Л. р. применяется в синтезе бициклич. третичных аминов, нек-рых пирролидиповых
и стсроидных алкалоидов.
Р-ция была впервые описана А. В. Гофманом на примере N-бромамидов в
1883. К. Лёфлер [Лефлер] и С. Фрайтаг в 1909 использовали эту р-цию для синтеза
никотина.
Лит.: Вейганд К., Хильгетаг Г., Методы эксперимента в органической
химии, пер. с нем., М.. 1968. с. 410; Общая органическая химия, пер. с
англ., т. 3, М., 1982, с. 340-41., К. В. Вацуро.

