ШМИДТА РЕАКЦИЯ
, взаимод. карбонильных
соед. с азотистоводородной к-той HN3 в присут. сильных к-т с
образованием аминов (из карбоновых к-т), амидов (из кетонов) или нитрилов
(из альдегидов):
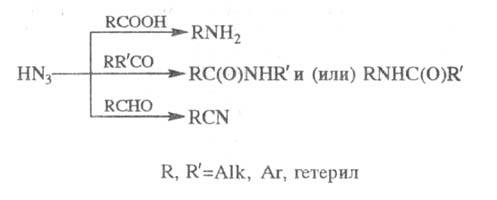
Обычно Ш. р. проводят в среде р-рителя
(напр., СНС13, С6Н6), добавляя NaN3
или р-р HN3 к смеси карбонильного соед. с конц. H2SO4
(вместо последней иногда используют НС1, CF3COOH, к-ты Льюиса
и др.). Выходы колеблются в очень широких пределах, в случае гладко реагирующих
карбоновых к-т и кетонов приближаясь к количественным.
В Ш. р. более активны алифатич. и алициклич.
соед., причем альдегиды и кетоны реагируют легче к-т (благодаря этому из
кетокислот можно получать продукты р-ции только по кетогруппе). Циклич.
кетоны в условиях Ш. р. дают лактамы, алкиларилкетоны - преимущественно
N-ариламиды. Многие a-замещенные
карбоновые к-ты (напр., глицин, a-аланин,
гиппуровая, фенилуксусная и др.) в Ш. р. не вступают.
Альдегиды и кетоны в условиях Ш. р. часто
образуют в качестве побочных продуктов тетразолы; последние как основной
продукт образуются при использовании избытка HN3, напр.:
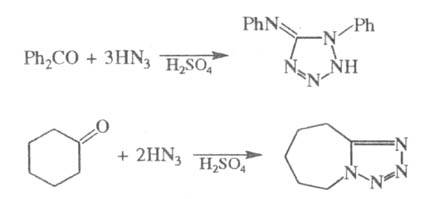
При проведении р-ции с a-галогенкарбоновыми
к-тами в заметной степени идут процессы дегидрогалогенирования.
Считается, что Ш. р. протекает через стадию
образования протонированного азида, в случае карбоновых к-т образованию
последнего предшествует стадия ацильного расщепления:
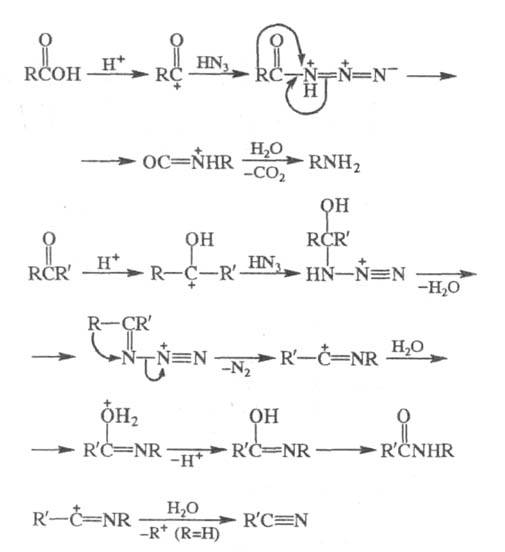
К модификациям Ш. р. относят взаимод. HN3
с нек-рыми производными карбоновых к-т (напр., ангидриды, хлорангидриды,
сложные эфиры дают с низкими выходами амины), хинонами (дают ароматич.
амины, иногда азиды или азотсодержащие гетероциклы), HCN, цианидами, оксимами,
амидоксимами, лактамами, хлорангидридами гидроксамовых к-т, имидохлоридами
и имидоэфирами (все дают с хорошими выходами тетразолы). Спирты и алифатич.
ненасыщ. соед. дают с HN3 основания Шиффа.
Недостаток Ш. р.- необходимость (в большинстве
случаев) ее осуществления в сильно кислой среде, что может способствовать
протеканию побочных процессов. В то же время Ш. р. имеет преимущества в
синтезе аминов перед р-цией Курциуса и перегруппировкой Гофмана (см. Гофмана реакции
)благодаря простоте эксперимента и часто более высоким выходам
конечных продуктов.
Ш. р. используют в препаративной практике,
а также при исследовании структуры сложных орг. соед. Р-ция открыта К.
Шмидтом в 1923.
Лит.: Вольф Г., в сб.: Органические
реакция, пер. с англ., сб. 3, М., 1951, с. 293-321;Органикум, пер. с нем.,ч.2,М.,
1979, с. 277-80; Марч Дж., Органическая химия, пер. с англ., т. 4, М.,
1988, с. 159-61.
Г. И. Дрозд.

