ХИНОЛИНОВЫЕ АЛКАЛОИДЫ
,
содержат
в молекуле остаток хинолина
или нек-рых его производных. Включают
более 300 представителей. Выделены из растений 14 семейств, а также нек-рых
микроорганизмов и животных. Наиб. богатые ими растения семейства рутовых
(Rutaceae), мареновых (Rubiaceae), парнолистниковых (Zygophyliaceae) и
сложноцветных (Compositae).
Различают след. основные группы X. а.:
1) простые хинолины (общая ф-ла I; R = Н, ОСН3, R = алкил,
арил), 4-хинолоны (II; R = Н, СН3, R = Н, алкил, арил) и 2-хинолоны
(III; R = Н, СН3, R = Н, алкил, алкенил); 2) гемитерпеноидные
и терпеноидные трициклич. производные типов IV-Х; З) фуранохинолины, к
к-рым относятся, в частности, производные диктамнина (XI; R = ОСН3)
и соед. типа ХII; 4) димерные алкалоиды, напр. ХIII. К X. а. иногда относят
также соед., содержащие кроме хинолина остатки хинуклидина (в частности,
хинин
), -карболина
(как в XIV) и др.; однако чаще их выделяют в отдельный класс алкалоидов,
специфичный для растений определенных родов, напр. хинного дерева (Cinchona),
селитрянки (Nitraria).
-карболина
(как в XIV) и др.; однако чаще их выделяют в отдельный класс алкалоидов,
специфичный для растений определенных родов, напр. хинного дерева (Cinchona),
селитрянки (Nitraria).
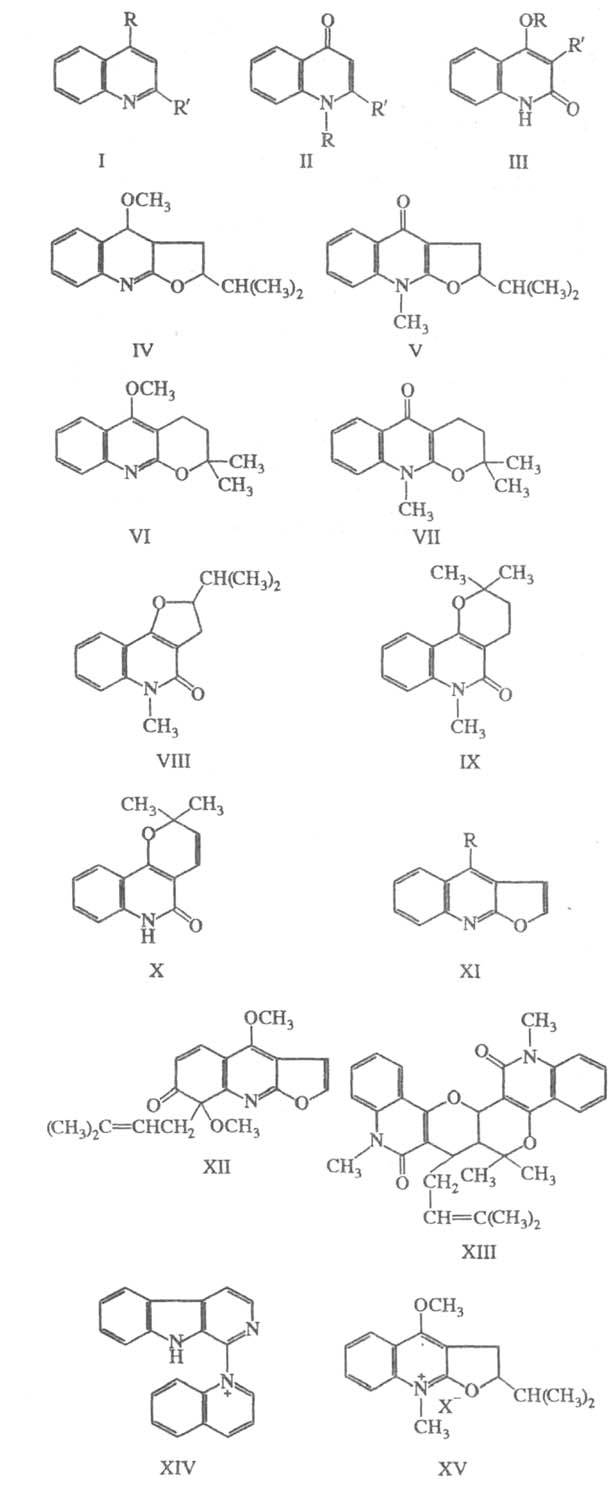
Каждой группе алкалоидов присущи характерные
хим. и спектральные св-ва. Общие св-ва Л. а., содержащих в положениях 2
или 4 метоксигруппу: а) способность изомеризоваться при нагр. с СН3I
в N-метил-2(или 4)-хинолоны (напр., IV изомеризуется в V, VI - в VII);
б) легкость гидролиза (дементирования) в щелочной или кислой среде, напр.,
XI (R = OCH3)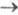 XI (R=OH). Природные и синтетич. четвертичные X. а. при пиролизе или нагревании
с безводным пиридином превращаются в соответствующие третичные основания,
напр. соединение XV в IV.
XI (R=OH). Природные и синтетич. четвертичные X. а. при пиролизе или нагревании
с безводным пиридином превращаются в соответствующие третичные основания,
напр. соединение XV в IV.
2-Хинолоны, напр., 4-метокси-3-пренил-2-хинолон
[III; R = CH3, R = СН2СН = С(СН3)2]
при нагр. с конц. НС1 или НВr в ледяной СН3СООН образует трициклические
X. а. типа VII и IX.
Характерная р-ция фуранохинолиновых алкалоидов
(XI) -гидрогенолиз фуранового кольца с образованием З-этил-2-хинолоновых
производных (III; R = СН3, R = С2Н5).
Для исследования структуры X. а. используют
спектральные методы. По значению максимумов поглощения в ЙК и УФ спектрах
и характеру их смещения в зависимости от рН среды различают не только группы
X. а., но и иногда положения заместителей. Mace-спектрометрия позволяет
установить принадлежность алкалоида к определенной группе и различать такие
близкие изомеры, как V и VII; VIII и IX. По положению и интегральной интенсивности
полосы поглощения в области 1610-1665 см-1 ИК спектра можно
различить 2- и 4-хинолоны, а также изомерные соединения V и VIII, VII и
IX. В большинстве случаев о полной структуре X. а. можно судить по данным
спектров ЯМР 1Н и 13С.
Различные X. а. имеют разных биогенетич.
предшественников. Так биосинтез хинина и производных кинуреновой к-ты (I;
R = ОН, R = СООН) осуществляется из триптофана, а Х. а. семейства рутовых
(соед. I-ХIII, XV) - из антраниловой кислоты.
X. а. обладают широким спектром физиологич.
активности. Большинство алкалоидов оказывает успокаивающее действие на
центр. нервную систему: нек-рые из них, напр. флиндерсин (X), проявляют
антифидантные св-ва. В медицине применяется хинин и эхинопсин (II; R =
CH3, R = Н) как стимулятор центр. и периферич. нервной системы.
Лит.: Садритдинов Ф. С., Курмуков
А. Г., Фармакологах растительных алкалоидов и их применение в медицине,
Таш., 1980; Беесонова И. А., Юнусов С. Ю., "Химия прир. соед.", 1989, №
1, с. 4-18; Маnske R.H.E, Rodrigо R., в кн.: The Alkaloids, v. 17. N. Y.,
1979, p. 105-200.
И. А. Бессонова.
|

