ХРОНОПОТЕНЦИОМЕТРИЯ
, электрохим.
метод исследования и анализа, основанный на изучении изменения электродного
потенциала Е во времени при контролируемом значении тока электролиза.
Различают прямую и инверсионную X. Чаще применяют первый вариант. В этом
случае электролиз осуществляют в неперемешиваемом р-ре определяемого электрохимически
активного (электроактивного) в-ва при большом избытке фонового электролита;
при этом значение тока, как правило, превышает предельный диффузионный
ток ld (см. Вольтамперометрия
). Используют двух-
и трехэлектродные ячейки (см. Хроноамперометрия
). Регистрируют хроно-потенциометрич.
кривую - зависимость электродного потенциала рабочего электрода (на к-ром
происходит электролиз) от времени t.
У пов-сти рабочего электрода постепенно
уменьшается концентрация исследуемого в-ва и соответственно изменяется
электродный потенциал в сторону более отрицат. значений. В конце электролиза
наблюдается резкий скачок потенциала. Интервал времени, в течение к-рого
концентрация электроактивного в-ва уменьшается практически до 0, наз. переходным
временем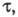 причем
причем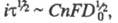 где С - объемная концентрация злектроактивного в-ва; п - число электронов,
участвующих в электрохим. процессе; F- число Фарадея; D0
- коэф. диффузии окисленной формы в-ва; i - плотность электрич.
тока. При постоянных значениях С и площади пов-сти электрода произведение
где С - объемная концентрация злектроактивного в-ва; п - число электронов,
участвующих в электрохим. процессе; F- число Фарадея; D0
- коэф. диффузии окисленной формы в-ва; i - плотность электрич.
тока. При постоянных значениях С и площади пов-сти электрода произведение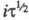 =
const. Изменяя i, можно менять величину
=
const. Изменяя i, можно менять величину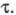 Необходимые условия проведения анализа - отсутствие конвекции и малое значение
тока, расходуемого на заряжение двойного электрич. слоя. Обычно продолжительность
электролиза t не превышает ~ 30 с, так как при больших t на
величину
Необходимые условия проведения анализа - отсутствие конвекции и малое значение
тока, расходуемого на заряжение двойного электрич. слоя. Обычно продолжительность
электролиза t не превышает ~ 30 с, так как при больших t на
величину оказывают сильное влияние емкость двойного электрич. слоя, конвекция, адсорбция
и др. факторы. Величина
оказывают сильное влияние емкость двойного электрич. слоя, конвекция, адсорбция
и др. факторы. Величина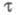 зависит также от формы электрода: для цилиндрич. электрода она меньше,
чем для сферического с такими же радиусом и площадью пов-сти. Если ток
электролиза является ф-цией
зависит также от формы электрода: для цилиндрич. электрода она меньше,
чем для сферического с такими же радиусом и площадью пов-сти. Если ток
электролиза является ф-цией то
то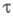 ~ С. Это соотношение лежит в основе количеств. хим. анализа. Значение
~ С. Это соотношение лежит в основе количеств. хим. анализа. Значение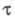 определяют по хронопотенциометрич. кривой, вид к-рой зависит от характера
электрохим. процесса.
определяют по хронопотенциометрич. кривой, вид к-рой зависит от характера
электрохим. процесса.
Для обратимого электрохим. процесса, скорость
к-рого ограничивается диффузией электроактивного в-ва (диффузионный процесс
с переходным временем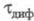 ),
электродный потенциал
),
электродный потенциал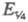 при
при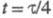 равен потенциалу полуволны Е1/2. Причем выражение
для хронопотенциометрич. кривой в координатах E-t совпадает с ур-нием
для вольтамперометрич. волны, если вместо Е1/2, ldи
I
подставить соотв.
равен потенциалу полуволны Е1/2. Причем выражение
для хронопотенциометрич. кривой в координатах E-t совпадает с ур-нием
для вольтамперометрич. волны, если вместо Е1/2, ldи
I
подставить соотв.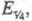
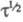 и
и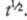
Для необратимого электрохим. процесса
форма хронопотенциометрич. кривой определяется произведением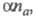 где
где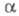 - коэф. переноса электрона; па - число электронов, участвующих
в медленной стадии электрохим. р-ции. Величина
- коэф. переноса электрона; па - число электронов, участвующих
в медленной стадии электрохим. р-ции. Величина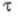 не зависит от кинетики электродной р-ции. При t = 0 значение Е определяется
константой скорости kf прямой гетерог. электрохим. р-ции,
величинами
не зависит от кинетики электродной р-ции. При t = 0 значение Е определяется
константой скорости kf прямой гетерог. электрохим. р-ции,
величинами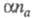 и i. Чем меньше kf , тем большее перенапряжение
необходимо для протекания этого процесса. Величина смещения хронопотенциометрич.
кривой в отрицат. область потенциалов возрастает с увеличением i. Это
справедливо для процессов, протекающих на электродах сферич. и цилиндрич.
формы. Условие необратимости электродного процесса в X.:
и i. Чем меньше kf , тем большее перенапряжение
необходимо для протекания этого процесса. Величина смещения хронопотенциометрич.
кривой в отрицат. область потенциалов возрастает с увеличением i. Это
справедливо для процессов, протекающих на электродах сферич. и цилиндрич.
формы. Условие необратимости электродного процесса в X.: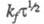 < 2,8 x 10-2 см x с-1/2. Использование приема
реверса (изменения знака) тока позволяет изучать процессы восстановления
(катодные с
< 2,8 x 10-2 см x с-1/2. Использование приема
реверса (изменения знака) тока позволяет изучать процессы восстановления
(катодные с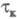 )
и окисления (анодные с
)
и окисления (анодные с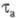 ),
при этом
),
при этом
Если скорость электрохим. р-ции лимигируется
скоростью образования в р-ре электроактивного в-ва из определяемого компонента,
то процесс наз. кинетическим (переходное время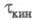 ); причем
); причем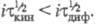 При i
При i 0 значение
0 значение для кинетич. и диффузионных процессов сближаются. Увеличение i приводит
к линейному уменьшению
для кинетич. и диффузионных процессов сближаются. Увеличение i приводит
к линейному уменьшению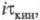 тем более резкому, чем меньше константа равновесия К и константа
скорости k1 прямой хим. р-ции образования электроактивного
в-ва. В случае каталитич. электродного процесса (см. Полярография
)с
переходным временем
тем более резкому, чем меньше константа равновесия К и константа
скорости k1 прямой хим. р-ции образования электроактивного
в-ва. В случае каталитич. электродного процесса (см. Полярография
)с
переходным временем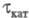 величина
величина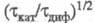 зависит от параметра
зависит от параметра ; причем
; причем где Ск - концентрация катализатора. При
где Ск - концентрация катализатора. При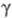 > 2 наблюдается линейная зависимость отношения
> 2 наблюдается линейная зависимость отношения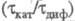 от
от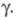
В инверсионной X. предварительно проводят
электролиз (электролитич. концентрирование) определяемого в-ва в течение
времени tK при заданном токе или потенциале. Выделенное
на электроде в-во растворяют электрохимически при i = const или
химически (чаще окислением, напр. с помощью Hg2+ или О2).
Величина обычно пропорциональна концентрации электроактивного в-ва и времени tK.
обычно пропорциональна концентрации электроактивного в-ва и времени tK.
X. применяют для определения ионов металлов
в объектах окружающей среды (сточных и прир. водах, почвах, растениях,
осадочных горных породах), а также в биосредах (кровь, моча). Пределы обнаружения
достигают неск. мкг/л; относит. стандартное отклонение - неск. % (для малых
концентраций менее 0,25%).
Лит.: Галюс З., Теоретические основы
электрохимического анализа, пер. с польск., М., 1974; Агасян П. К. [и др.],
"Ж. аналит. химии", 1976, т. 31, в. 1, с. 121-42; Захаров М. С., Баканов
В. И., Пнев В. В., Хронопотенциометрия, М., 1978.
А. И. Каменев.
|

