КВАЗИСТАЦИОНАРНОСТИ ПРИБЛИЖЕНИЕ
(метод квазистационарных концентраций) в хим. кинетике, прием, упрощающий определение скорости сложной хим. р-ции. При стационарной хим. р-ции в каждом элементе реакц. пространства концентрации реагентов, продуктов и промежут. в-в, а также т-ра и, если р-ция каталитическая, активность катализатора не изменяются со временем. Очевидно, что строго стационарное протекание р-ции возможно только в открытой системе
; в закрытой системе всегда происходит постепенное изменение концентрации реагентов в результате хим. превращ., поэтому скорость р-ции и концентрации промежут. в-в также изменяются. Если в ходе р-ции концентрации промежут. в-в хотя и не равны тем, к-рые были бы при стационарном течении р-ции, но отличаются от них настолько мало, что скорость р-ции в каждом элементе реакц. пространства и в каждый момент времени практически равна скорости стационарной р-ции при данных концентрациях реагентов и продуктов, то говорят, что р-ция квазистационарна. Квазистационарная р-ция возможна не только в открытой, но и в закрытой системе.
Кинетику квазистационарной р-ции с достаточным приближением рассматривают так, как если бы р-ция была строго стационарной. Этот прием, наз. методом Боденштейна, значительно облегчает вывод кинетич. ур-ний, связывающих скорости р-ции по отдельным в-вам с концентрациями в-в. Система дифференц. ур-ний, получаемых в результате применения закона действующих масс к элементарным стадиям, сводится к системе алгебраич. ур-ний, поскольку все производные концентраций промежут. в-в по времени полагают равными нулю. Согласно условию Христиансена, метод Боденштейна применим, если времена жизни промежут. в-в малы по сравнению с временем, за к-рое состав реагирующей системы существенно изменяется. Кроме того, разумеется, необходимо, чтобы механизм р-ции допускал ее стационарное протекание, т.е. чтобы упомянутая система алгебраич. ур-ний имела решение (или конечное число решений).
В случае нестационарных р-ций, напр. цепных реакций с разветвляющимися цепями, используют метод Семенова: приравнивают к нулю производные по времени концентраций всех промежут. в-в, кроме одного, обладающего наиб, временем жизни.
К. п. можно считать применимым, если за время порядка времени релаксации скорости р-ции состав реагирующей системы мало изменяется (время релаксации скорости р-ции определяется как время, за к-рое при постоянных концентрациях всех в-в отклонение скорости р-ции от значения, соответствующего стационарному протеканию, уменьшается в е раз). Для оценки верх, границы времени релаксации каталитич. р-ций в простых случаях может служить время оборота катализатора (см. Каталитических реакций кинетика
). Точное определение необходимых и достаточных условий применимости К. п.-сложная математич. задача. М. И. Тёмкин [Темкин].
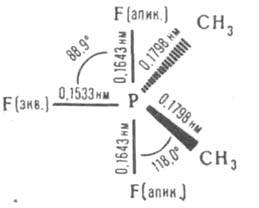
КBАЗИФОСФОНИЕВЫЕ СОЕДИНЕНИЯ, соединения общей ф-лы RnРНаl5-n, где R=Alk, Ar, OAlk, SAlk, NHAlk, Н; п=1-4. Атом фосфора в К. с. может иметь тетраэдрич. конфигурацию (напр., в [RP(OR)3]+ Наl-) или октаэдрическую (напр., в [RPF5]- [RPF3]+). По мере увеличения суммы электроотрицательностей заместителей у атома Р возрастает вероятность существования К. с., у к-рых все связи ковалентные. Молекулы последних имеют обычно форму искаженной тригональной бипирамиды, в к-рой более электроотрицат. заместители занимают, как правило, апикальные положения, см., напр., ф-лу:
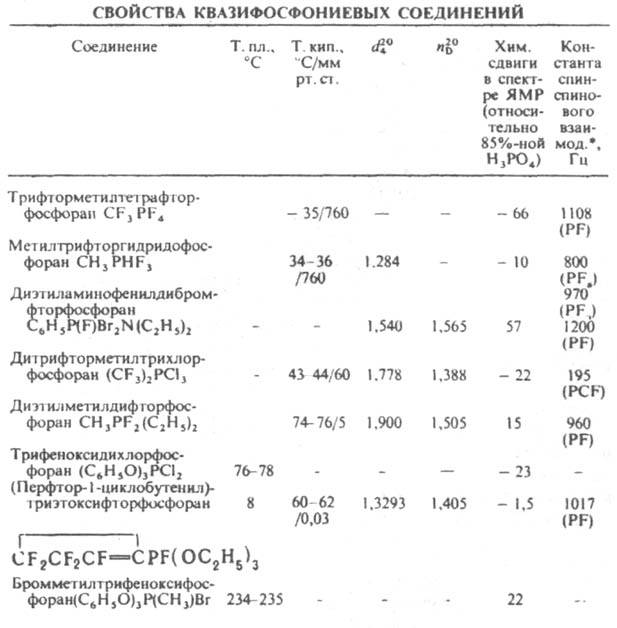
Большинство К. с. со связью Р—F - жидкости, хлориды и др. галогенопроизводные - обычно кристаллы (см. табл.). К. с. раств. в галогензамещенных предельных и ароматич. углеводородах. Как правило, реагируют с водой и др. соед., содержащими реакционноспособные функц. группы.
Реакц. способность К. с. возрастает с увеличением числа атомов Hal у атома фосфора. Для К. с. характерны р-ции замещения Hal (ур-ния 1,2), комплексообразования (3), диспропорционирования (4), восстановления (5) и образования илидов фосфора (6), напр.:
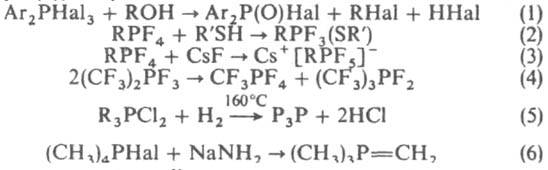
Методы получения К. с.: взаимод. производных трехвалентного Р с электроф. реагентами, напр. RPHal2 + RHal:RRPHal3; р-ции производных четырехкоординационного Р с галогенирующими агентами, напр. R3P=S+ SbF3:R3PF2; замещение в пентагалогенидах и пентаорганофосфоранах, напр., РС15+ЗС6Н5ОН:(С6Н5О)3РС12.
* В скобках атомы, между к-рыми осуществляется взаимод., индексы "а" и "э" обозначают соотв. апикальный и экваториальный атом.
К. с. используют для получения алкилгалогенидов, алке-нов сложного строения. (см. Виттига реакция
), инсектицидов и фунгицидов, а также как огнестойкие и антистатич. пропитки тканей и бумаги, ингибиторы коррозии.
Лит.: Пурдела Д., Вылчану Р.. Химия органических соединений фосфора, пер. с рум.. М.. 1972, с. 265 304; Корбридж Д., Фосфор. Основы химии, биохимии, технологии, пер. с англ., М., 1982. с. 215 40. Г. И. Дрозд.
|

