ЩЕЛОЧНЫЕ МЕТАЛЛЫ
:литий
Li, натрий
Na, калий
К, рубидий
Rb, цезий
Cs,
франций
Fr. Щ. м., кроме Cs, имеют серебристый металлич. блеск, Cs -
золотисто-желтую окраску. Все Щ. м. очень мягки, легко режутся (кроме Li), Rb,
Cs и Fr при обычной т-ре почти пастообразны. наиб. твердый из них Li мягче талька
(твердость талька принята за единицу по шкале Мооса). Щ. м. кристаллизуются
в кубич. объемноцентрир. решетке с пространств, группой IтЗт,
z = 2. Т-ры плавления Щ. м. уменьшаются от Li к Cs: 180,54 °С (Li), 97,86 °С
(Na), 63,51 °С (К), 39,32 °С (Rb), 28,44 °С (Cs). Щ. м. очень легкие, самый
легкий среди всех известных металлов - Li, он плавает в керосине, a Na и К легче
воды.
Сильно электроположит. характер и высокая
хим. активность Щ. м. обусловлены небольшой затратой энергии на отрыв от
атомов этих металлов одного s-электрона. Первые потенциалы ионизации
(эВ): 5,39178 (Li), 5,13915 (Na), 4,34070 (К), 4,17719 (Rb), 3,89397 (Cs).
Щ.м.- сильные восстановители. Значения их стандартных электродных потенциалов
(В) для полур-ции М+ + е- = М: -3,045 (Li), -2,711
(Na), -2,924 (К), -2,925 (Rb), -2,923 (Cs). Литий стоит первым в электрохим.
ряду напряжений металлов.
Характерное св-во атомов Щ. м.- легкость
возбуждения у них светового излучения. Оптич. спектры Щ. м. просты и содержат
очень яркие линии (нм): 610,36 и 670,78 (Li), 589,59 и 588,99 (Na), 766,49
(К), 794,76 и 780,02 (Rb), 894,5 и 852,11 (Cs). Интенсивность линий 852,11,
780,02, 766,49 и 588,99 в атомных спектрах - наиб. среди всех элементов
периодич. системы. Летучие соли Li окрашивают пламя газовой горелки в карминово-красный
цвет, К - в розово-фиолетовый, a Na -в желтый, пары Rb окрашены в зеленовато-синий
цвет, пары Cs - в сине-зеленый.
На воздухе все Щ. м. быстро покрываются
темно-серым налетом, состоящим из оксидов, только у Li появляется зеленовато-черная
пленка нитрида Li3N. Склонность к окислению на воздухе возрастает
от Li к Fr, причем Rb, Cs и Fr окисляются уже с воспламенением. Поэтому
Щ. м. хранят под слоем обезвоженного парафинового или вазелинового масла.
С водой Щ. м. реагируют бурно с образованием щелочей (откуда название)
и выделением Н2, при этом Rb и Cs взаимод. даже со льдом при
-100 °С. С метанолом и этанолом Щ. м. дают алкоголяты и Н2.
Кислород окисляет все Щ. м., но если Li
превращается только в Li2O, то остальные Щ. м.- в смеси, в основном
М2О2 и МО2, при этом Rb и Cs вспыхивают.
С N2 реагирует в обычных условиях только Li, превращающийся
в нитрид, для остальных Щ. м. нитриды неизвестны. Щ. м. растворяются в
жидком аммиаке, некоторых алкиламинах и полиэфирах с образованием синих
растворов, обладающих электронной проводимостью (см. Сольватированный электрон
). При хранении синие аммиачные растворы обесцвечиваются в
результате медленно протекающей реакции: 2M + 2NH3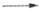 2MNH2
+ Н2. Растворы Щ. м. в жидком аммиаке взаимодействуют с ацетиленом
с образованием ацетиленидов М2С2. При нагревании
К, Rb и Cs с графитом получают С8МХ, С24МХ,
С36МХ и другие нестехиометрические соединения
в виде медно-красных порошков, самовоспламеняющихся на воздухе и разлагающихся
водой с выделением Н2. Щ. м. энергично взаимод. с галогенами
с образованием галогенидов. При нагревании с S Щ. м. дают сульфиды, с Н2
- гидриды, с Р -фосфиды. Большинство солей Щ.м. хорошо растворимо в воде,
малорастворимы - фторид, фосфат и карбонат лития, а также МСlO4,
MMnO4, MReO4, где М = Rb и Cs.
2MNH2
+ Н2. Растворы Щ. м. в жидком аммиаке взаимодействуют с ацетиленом
с образованием ацетиленидов М2С2. При нагревании
К, Rb и Cs с графитом получают С8МХ, С24МХ,
С36МХ и другие нестехиометрические соединения
в виде медно-красных порошков, самовоспламеняющихся на воздухе и разлагающихся
водой с выделением Н2. Щ. м. энергично взаимод. с галогенами
с образованием галогенидов. При нагревании с S Щ. м. дают сульфиды, с Н2
- гидриды, с Р -фосфиды. Большинство солей Щ.м. хорошо растворимо в воде,
малорастворимы - фторид, фосфат и карбонат лития, а также МСlO4,
MMnO4, MReO4, где М = Rb и Cs.
Основной метод получения Щ. м.- термическое
восстановление хлоридов и бромидов магнием, кальцием, кремнием и другими
восстановителями в вакууме при 600-800 °С. Выделенные металлы очищают от
примесей ректификацией или вакуумной дистилляцией.
Лит.: Плющев В.Е., Степин Б. Д.,
Химия и технология лития, рубидия и цезия, М., 1970; Натрий, М., 1986;
Степин Б.Д., Цветков А. А., Неорганическая химия, М., 1994.
Б. Д. Степин.
|

