КОЛЛИДИНЫ
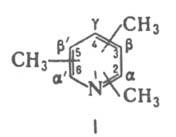
(тримстилпиридины), мол. м. 121,18, соед. ф-лы I.
Бесцв. жидкости (см. табл.) с запахом пиридина, хорошо раств. в орг. р-рителях, хужеводе; рКа 7,4-7,6. Образуют соли с сильными к-тами, комплексы с к-тами Льюиса, четвердами,
тичные соли с алкилгалогени, N-оксиды при действии надкислот. Гидрируются в присут. Pt, Ni или восстанавливаются Na в спирте до алкилпиперидинов. Окисляются сильными окислителями в ди- или трипиридинкарбоновые к-ты; в условиях окислит. аммонолиза превращ. в нитрилы. К. легче подвергаются электроф. замещению, чем пиридин и его монометилпроизводные-пиколины. По метильным группам в положении 2 или 4 К. реагируют с альдегидами и нитрозосоединениями, окисляются в присут. SeO2 до альдегидов, при действии NaNH2 или C6H5Li образуют металлоорг. соединения (см. Пиколины
).

Т.пл. -11.5 °С. Т.пл. -44,2 °С. Т.пл. 36,8°С При 25°С
К. выделяют из кам.-уг. смолы в смеси с др. пиридиновыми основаниями (коллидиновая фракция, т. кип. 160 171 °С). Синтезируют К. взаимод. NH3 с альдегидами, кетонами или ацетиленовыми соединениями. 2,4,6-Триметилпиридин (симметричный К.) получают циклоконденсацией ацетальдегида с ацетоуксусным эфиром и NH3 (см. Ганча синтезы
). Нек-рые К. получают препаративно путем дегалогенирования галогенколлидинов. Симметричный К.-эффективный дегидрогалогенирующий агент. Смесь К. с др. пиридиновыми основаниями - р-ритель.
Лит.: Петренко Д.С, Пиридиновые и хинолиновые основания, 2 изд.. М.. 1973; Ивановский А.П., Кутьин A.M., Шиханов В.А.. Промышленные способы получения алкилпиридинов, М., 1978. Л.Н Яхонтов
|

