ЛЕКТИНЫ
(от лат. lego - выбираю), белки, обладающие св-вом специфично и обратимо связывать углеводы или их остатки в биополимерах (напр., в гликопротеинах). Широко распространены в живой природе. В зависимости от источника получения различают бактолектины, миколектины, фитолектины и зоолектины. Структура молекул Л. весьма разнообразна. Их мол. масса находится в пределах от 5 до 400 тыс.; молекулы содержат от 1 до 20 субъединиц. Большинство Л. - гликопротеины, многие содержат координационно связанные Са2+ и Мn2+ , к-рые необходимы для проявления биол. активности. Для нек-рых Л. известна пространств. структура. Впервые она была изучена у конканавалина А, выделенного из растения канавалия мечевидная. Его молекула построена из четырех одинаковых полипептидных цепей с мол. м. ок. 26 тыс. В каждой цепи находится по одному иону Са2+ и Mn2+ и один центр связывания углевода. Ряд Л. (напр., рицин
) обладает высокой токсичностью.
Л. дают ряд характерных иммунологич. р-ций: агглютинацию (склеивание) клеток, в т.ч. эритроцитов (отсюда синоним Л. - фитогемагглютинины, к-рый используют обычно применительно к Л. фасоли), преципитацию (осаждение) гликопротеинов и полисахаридов, подавление активности Л. гаптенами (углеводами). Нек-рые Л. вызывают избирательную агглютинацию злокачеств. опухолевых клеток, что указывает на различие в структуре пов-стей последних и нормальных клеток.
Классифицируют Л. в зависимости от специфичности их взаимод. с разл. остатками моносахяридов. Среди последних различают 4 осн. группы с разным положением групп ОН при атомах С-3 и С-4 в пиранозном цикле:
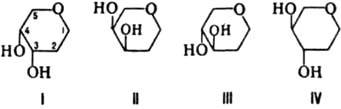
К 1-й группе относится, напр., остаток L-фукозы, ко 2-й - D-галактозы, к 3-й - D-маннозы и D-глюкозы, к 4-й - L-ксилозы. Известные Л. дифференцируют первые 3 группы углеводов; Л., специфичные к углеводам, содержащим
остатки 4-й группы моносахаридов, не найдены. Особенно важна тонкая углеводная специфичность Л., т.е. сродство их к сложным углеводным структурам, к-рые встречаются в природе. Примеры таких структур и специфичных к ним Л. приведены в таблице.

* Углеводная детерминанта (она подчеркнута) представлена в составе углеводной цепи; Gal - галактоза, GalNAc - N-ацетилгалактозамин, GlcNAc - N-ацетилглюкозамин, Маn - манноза, Fuc - фукоза, NeuNAc - N-ацетилнейраминовая к-та, X - остаток маннозы, глюкуроновой или мураминовой к-ты, R - несущественная для распознавания часть углеводной цепи, Asn - остаток аспарагина в гликопротеине.
Считается, что Л. растений выполняют ф-ции запасного и связующего материала семян; осуществляют транспорт углеводов и защиту от бактерий и грибов, участвуют в распознавании и прикреплении бактерий-симбионтов (напр., азотфиксирующих бактерий) к корневым волоскам растения-хозяина. Предполагают, что зоолектины участвуют в механизмах клеточного взаимодействия и узнавания, связывания и удаления из кровотока деградированных гликопротеинов.
Важнейшие источники Л. - семена растений, особенно бобовых (в последних их содержится 2-10% от общего кол-ва белков). Для выявления Л., как правило, используют р-цию агглютинации интактных или модифицир. эритроцитов. Очистку Л. осуществляют так же, как и др. белков, в т. ч. с помощью аффинной хроматографии, используя в качестве сорбентов полисахариды, гликопротеины и синтетич. углеводы, иммобилизованные на носителе.
Л. применяют для аффинной очистки гликопротеинов и гликолипидов, при исследовании структуры углеводных цепей, для изучения распределения и структуры углеводных детерминант пов-сти клеточных мембран, для стимуляции лимфоцитов (конканавалином А, фитогемагглютинином фасоли и нек-рыми др. Л.), а также для диагностики групп крови и выявления групповых детерминант в гликопротеинах биол. жидкостей.
Лит.: Линевич Л. И., "Успехи биологической химии", 1979, т. 20, с. 71-94; Луцик М. Д., Панасюк Е. Н., Луцик А. Д., Лектины, Львов, 1981; Королев Н. П., в сб.: Итоги науки и техники, сер. Общие проблемы физико-химической биологии, т. 1, М., 1984; Лахтин В. М., "Биотехнология", 1985, №5, с.11-27; Gold E., Balding P., Receptor-specific proteins: plant and animal lectins, N.Y., 1975; Brown J., Hunt R., "Internal. Rev. Cytol.", 1978, v. 52, p. 277-349; Goldstein I., Hayes C, в сб.: Advances in carbohydrate chemistry and biochemistry, v. 35, N.Y., 1978, p. 127-340; Nicolson G., Irimura Т., "Biology of the Cell", 1984, v. 51, p. 157-64. М. Д. Луцик.
|

