ЛИМОННАЯ КИСЛОТА
(2-гидрокси-1,2,3-пропантрикарбоновая к-та) (НООССН2)2С(ОН)СООН, мол. м. 192,12; бесцв. кристаллы с моноклинной решеткой (а = 1,2817 нм, b = 0,5628 нм, с = 1,1465 нм, р 111,22° z = 4), пространств. группа P21/a; т. пл. 153,5 °С; d420 1,665; nD150 1,460; DH0cгор -1990 кДж/моль (30°С); рKa при 25°С 3,128, 4,761 и 6,388; р-римость (в %): в воде 59,2 (20 °С), 84 (100 °С), этаноле 38,3 (25 °С), диэтиловом эфире 1,05 (25 °С). Из водного р-ра при т-ре ниже 36,5°С кристаллизуется в виде моногидрата, для к-рого d420 1,542; nD20 1,498; DH0cгор -1973 кДж/моль; DH0обр - 1843 кДж/моль; р-римость (в %): в метаноле 66,6 (20 °С), этаноле 49,8 (25 °С), пропаноле 38,5 (20 °С), этилацетате 5,3 (25 °С), диэтиловом эфире 2,2 (25 °С), хлороформе 0,007 (25 °С).
Л. к. проявляет св-ва многоосновных карбоновых кислот
; образует три ряда солей и эфиров (цитратов) по карбоксильным группам. Ацилируется по группе ОН. Как гидроксикислота образует стабильные комплексы с многовалентными катионами. При нагр. до 175°С превращается в смесь аконитовой HOOCCH=С(COOH)CH2COOH и 3-кетоглутаровой HOOСCH2С(O)CH2COOH к-т, выше 175°С - в итаконовую к-ту. При окислении с помощью КMnО4 или Н2О2 образует 3-кетоглутаровую к-ту.
Л. к. - важный продукт обмена в-в в живых организмах, участвует в цикле трикарбоновых к-т и глиоксилатном цикле. Растения способны накапливать Л. к.; так, плоды цитрусовых содержат 6-8% Л. к., листья махорки - 8-14%, культуральные жидкости нек-рых бактерий - до 10%.
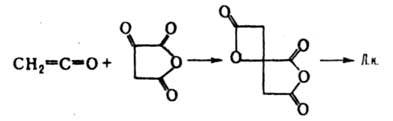
Осн. пром. способ получения Л. к. - сбраживание сахара, патоки или мелассы штаммами грибков Aspergillus niger. Получают ее также извлечением из растит. сырья или взаимод. кетена с ангидридом щавелевоуксусной к-ты:
Обнаружение Л. к. основано на образовании флуоресцирующих соед. при сплавлении, напр., с мочевиной или резорцином. Методы количеств. определения включают перманганато-, иодо- и ванадатометрию, а также превращение при действии брома в пентабромацетон, определяемый, напр., гравиметрически.
Л. к. и ее соли широко используют в пищ. пром-сти как вкусовые в-ва, в качестве компонентов буферных р-ров, для предохранения жиров от порчи, в фармацевтич. пром-сти как компоненты мн. лек. ср-в (лимоннокислый Na - антикоагулянт); Л. к. используется для снятия ржавчины и окалины с металлич. пов-стей, при электротравлении меди, в таннирующих р-рах в ситцепечатании, при произ-ве диазобумаг. Триэтиловый и трибутиловый эфиры ацетиллимонной к-ты - пластификаторы, триаллиловый эфир - мономер. Мировое произ-во Л. к. 250000т (1974), 65% используется в пищевой и 15% - в фармацевтич. пром-сти.
Лит.: Kirk-Othmer encyclopedia, 3 ed., v. 6, N.Y., 1979, p. 150-79.
Д. В. Иоффе.
|

