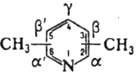
ЛУТИДИНЫ
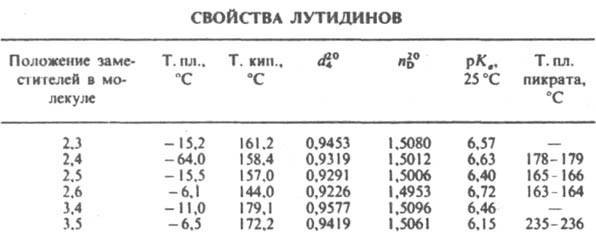
(диметилпиридины), мол. м. 107,15; бесцв. жидкости (см. табл.) с запахом пиридина; хорошо раств. в воде и орг. р-рителях. Образуют соли с сильными к-тами, четвертичные производные - с алкилгалогенидами, комплексы - с к-тами Льюиса.
Восстанавливаются водородом в присут. катализаторов или под действием Na в
спирте до диметилпиперидинов (лупетидинов). Сильными окислителями превращаются сначала в метилпиридинмонокарбоновые к-ты, затем в пиридиндикарбоновые к-ты; при действии SeO2 и в условиях контролируемого парофазного окисления превращ. в альдегиды. Более глубокое окисление идет с разрывом пиридинового кольца и образованием солей щавелевой и уксусной к-т. Л. (кроме 3,5-Л.) реагируют с альдегидами, нитрозосоединениями и др. реагентами. С сильными основаниями (NaNH2 в жидком NH3 при 40 °С; C6H5Li в эфире при 36 °С; C6H5MgBr в ТГФ при
120 оС) образуют по метильным группам С-металлопроизводные, к-рые легко взаимод. с электрофилами (алкилгалогенидами, карбонильными соед., СО2 и др.). В условиях радикального бромирования N-бромсукцинимидом превращ. в бромметильные производные.
Л. выделяют из кам.-уг. смолы или горючих сланцев в смеси с пиридиновыми основаниями с послед. ректификацией смеси; при этом образуются b-пиколиновая (т. кип. 136-146 °С, содержит 2,6-Л.) и лутидиновая (т. кип. 157-159°С, содержит гл. обр. 2,5- и 2,4-Л.) фракции. Чистые Л. выделяют обычно в виде комплексов с мочевиной (2,6-Л.) или гидрохлоридов. Л. образуются при разложении в жестких условиях нек-рых алкалоидов (протовератрина, нанодина и др.), пиролизе прир. продуктов (древесины, хлопка и т.п.). Синтезируют Л. взаимод. NH3 с альдегидами, кетонами (р-ция Чичибабина), ацетиленами, а 2,6-Л. - также из NH3, ацетоуксусного эфира и СН2О (р-ция Ганча).
2,6-Л . - сырье в произ-ве лек. препаратов (напр., пармидина, димеколина), акцептор к-т в процессах дегидрогалогенирования и при получении ортоэфиров (где он эффективнее AgCO3).
Лит.: Физер Л., Физер М., Реагенты для органического синтеза, пер. с англ., т. 2, М., 1970; Русьянова Н. Д., Коган Б. Е., Косарева М. А., "Химия гетероцикл. соединений", 1976, № 12, с. 1587-1600; Яхонтов Л. Н., Карпман Я. С, там же, 1981, № 4, с. 435-47; Pyridines and its derivatives, ed. by E. KlingsberR, pt I, N. Y.- L, 1960. Л. Н. Яхонтов.
|

