АДЕНОЗИНМОНОФОСФАТ ЦИКЛИЧЕСКИЙ
(аденозин-3,5-циклофосфат; 3,5-АМФ;
цАМФ), мол. м. 329,22; бесцв. кристаллы;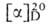 — 51°; соли Na, К и аммония хорошо раств. в воде, соли Ag и двухвалентных
металлов в воде практически не растворяются.
— 51°; соли Na, К и аммония хорошо раств. в воде, соли Ag и двухвалентных
металлов в воде практически не растворяются.
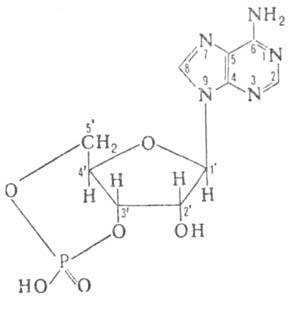
Конфигурация остатка рибозы в цАМФ-С3-эндо-С4-экзо
.
Циклофосфатное кольцо, конденсированное с рибозным циклом, имеет конформацию
кресла. Кристаллич. ячейка состоит из двух молекул, в одной из к-рых аденпновое
основание расположено в син-, а в другой-в анти-конформации относительно
рибозного кольца. Последняя конформация характерна также для молекул в
р-ре.
цАМФ-вторичный мессенджер, т.е. осуществляет ф-ции внутриклеточного
посредника в действии первичных мессенджеров-ряда гормонов и медиаторов
(передатчиков) нервного возбуждения. Участвует также в регуляции обмена
углеводов и липидов, клеточного роста, мембранного транспорта и др. В бактериальных
клетках цАМФ, взаимодействуя со специфич. рецепторным белком, вызывает
в нем конформационные изменения, в результате чего белок приобретает способность
связываться с клеточной ДНК и регулировать активность генов. В клетках
высших организмов цАМФ активирует фермент протеинкиназу, к-рый катализирует
перенос остатка фосфорной к-ты с АТФ на белок. Активация заключается в
связывании цАМФ с регуляторной субъединицей фермента, в результате чего
освобождается активная каталитич. субъединица, к-рая и осуществляет р-цию.
Протеинкиназа может катализировать фосфорилирование нек-рых ферментов,
а также ряда регуляторных и структурных белков, что приводит к изменению
их св-в. Так, фермент киназа фосфорилазы b фосфорилируется с образованием
активной формы, к-рая сама в свою очередь катализирует фосфорилирование
др. фермента-фосфорилазы b. Последняя ускоряет распад гликогена
в организме.
цАМФ оказывает влияние и на дефосфорилирование белков, к-рое осуществляется
под действием протеинфосфатаз. Так, Протеинкиназа фосфорилирует один из
белков, в результате чего он приобретает св-ва ингибировать фосфата-зу1-фермент,
катализирующий дефосфорилирование. Метаболизм цАМФ осуществляют два фермента
-аденил-атциклаза, катализирующая синтез цАМФ из АТФ, и фосфодиэстераза
цАМФ, к-рая катализирует гидролиз цАМФ по З-фосфоэфирной связи с образованием
5-аденозинмонофосфата.
А. ц. открыт Э. Сазерлендом в 1957. Его получают циклизацией 5-аденозинмонофосфата
под действием N, N-дициклогексилкарбодиимида.
Лит.: Васильев В. Ю., Гуляев Н. Н., Северин Е. С, "Ж. Всес. хим. об-ва
им. Д.И. Менделеева", 1975, т. 20, N? 3, с. 306-22; Ткачук В. А., "Укр.
биохим. ж.", 1981, т. 53, № 2, с. 5-27; Sharma R. К., "Progress in Nucleic
Acids Research and Molecular Biology", 1982, v. 27, p. 233-88. E.C.
Северин. В.Л. Туницкая.

