МАГНИЙОРГАНИЧЕСКИЕ СОЕДИНЕНИЯ
, содержат связь Mg—С Осн. типы M.c. - R2Mg, RMgX, где X = Hal, OR, SR, NRR. Наиб. важны RMgHal (Hal = Cl, Br, I), наз. реактивами Гриньяра, - бесцв. кристаллы или вязкие жидкости состава Mg : R : Hal = 1 : 1 : 1; устойчивы до 100-150°С. Получают и используют их гл. обр. в эфирном р-ре. Эфир полностью обычно не удаляется, и RMgHal, доведенные до постоянного веса в вакууме при 100°С, представляют собой смесь MgHal2 и [R2Mg]n; в твердом виде выделяются как комплексы с р-рителем состава 1:1 или 1:2. RMgHal, полученные в углеводородах, дают осадок MgHal2 и р-римое металлоорг. в-во, к-рое в твердом виде отвечает составу R3Mg2Hal.
В р-ре RMgHal существует равновесие Шленка, смещенное влево: 2RMgHal D MgHal2 + R2Mg. Стехиометрич. смесь MgHal2 и R2Mg в эфире дает продукт, полностью идентичный RMgHal. Полагают, что в равновесии Шленка участвуют сольватир. комплексы, напр.:
R2Mg.2ТГФ + MgHal2.4ТГФ D
2(RMgHal.nТГФ) + mТГФ (п = 2, 3, т = 0-2);
R2Mg.2(C2H5)2O + MgHal2.2(C2H5)2O D
2[RMgHal.2(C2H5)2O]
В гексаметаполе (L) главная форма - RMgHal.2L с частично ионной связью Mg—С. В углеводородах RMgHal образуют структуры с мостиковыми атомами галогена, RMgF в эфире и ТГФ - димер с мостиковыми атомами F.
Соед. RMgHal разлагаются выше 100°С по типу b-элиминирования, напр.: 2RCH2CH2MgHal : 2RCH=CH2 + MgH2 + MgHal2. Окисление RMgHal первоначально приводит к ROOMgHal, затем образуются ROMgHal. При действии орг. соед. с активным атомом водорода RMgHal дают RH. Эту р-цию (при R = СН3) используют для определения активного Н в орг. соед. (см. Церевитинова метод
). М.с. RMgHal разлагаются под действием воды и к-т, восстанавливаются Н2 при нагр. до RH, MgH2 и MgHal2. С галогенами образуют RHal и MgHal2, с S (и послед. гидролизом) - RSH, с SO2 - RSO2MgHal2, с СО2 - соли карбоновых к-т. С солями др. металлов реагируют по схеме:
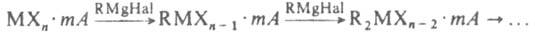
(А - р-ритель). Это осн. метод синтеза металлоорг. соед. переходных и непереходных металлов с s-связью металл-элемент. Р-ции способствуют более полярные р-рители.
В обычных условиях RMgHal не присоединяются к несопряженным алкенам и алкинам. При высоких т-ре и давлении RMgHal присоединяются к терминальным алкенам, сопряженным алкенам и алкинам, что используют как стадию в орг. синтезе. О наиб. важных р-циях RMgHal с соед., содержащими связи С=О,  , C=S и др., см. Гриньяра реакция
, Иоцича реакция
.
Соед. R2Mg - бесцв. твердые в-ва, обычно разлагающиеся при нагр. без плавления, для нек-рых R2Mg известны т-ры плавления. Плохо раств. в насыщ. углеводородах, лучше - в бензоле. Обычно кристаллизуются из полярных сред в виде комплексов с р-рителем составов 1:1 или 1:2, однако в отличие от RMgHal р-ритель м. б. легко удален в вакууме. В кристаллич. состоянии R2Mg(R = CH3, С2Н5) имеют структуру линейных полимеров с мостиковыми алкильными группами. В среде углеводородов R2Mg представляют собой димеры или тримеры, в эфире или ТГФ - сольватированные мономеры, однако при высоких концентрациях R2Mg возможна их ассоциация. Связь Mg—С в растворенных R2Mg обычно ковалентная, однако в гексаметаполе она существенно ионизирована. В эфирном р-ре (C5H5)2Mg существует как контактная ионная пара.
Наиб. термически стабильно соед. [(CH3)2Mg]n, к-рое разлагается выше 220 °С с выделением СН4 и образованием полимерного (CH2Mg)n. Выше 300°С при разложении образуются Н2 и MgC2. Др. R2Mg, где R - нормальный алкил, разлагаются при 170-210°С до MgH2 и алкенов, при
R = вторичный и третичный алкил - при более низких т-рах. По хим. св-вам R2Mg в целом аналогичны RMgHal, однако часто хим. р-ции R2Mg протекают с большими скоростями. Таковы, напр., р-ции с О2, СО2, Н2, р-ции с орг. соед. и др. Однако наблюдаются и нек-рые различия. Напр., 1,2-присоединения R2Mg к a,b-ненасыщенным кетонам, тогда как для RMgHal характерно 1,4-присоединение.
Получают R2Mg: осаждением диоксаном из эфирного р-ра RMgHal; р-цией с ртутьорг. соед. - R2Hg + Mg : R2Mg + Hg; (C5H5)2Mg м. б. получен при 500°C из С5Н6 и металлич. Mg.
Соед. типа RMgOR - кристаллы, нелетучи; плохо раств. в насыщ. углеводородах, раств. в ароматич. р-рителях. Образуют комплексы с эфиром, из к-рых он легко удаляется в вакууме. В твердом состоянии представляют собой линейные олигомеры, в р-ре образуют ассоциаты с мостиковыми атомами О. При пиролизе RMgOR при 200-340°С образуются алканы, алкены и MgO. Присоединяются к группе С=О альдегидов и кетонов, но менее легко, чем R2Mg, давая большее кол-во побочных продуктов. Получают их алкоголизом R2Mg.
Соед. типа RMgX, где X = SR, NRR, получают действием RSH или RRNH на R2Mg в эфире при низких т-рах.
М.с., образованные путем переноса электрона от Mg к ароматич. и др. ненасыщ. системам, менее изучены по сравнению с аналогичными соед. щелочных металлов.
М.с. в осн. используют в орг. синтезе и для получения металлоорг. соединений. В пром-сти М.с. в смеси с др. металлоорг. соед. применяют как катализаторы полимеризации.
Лит.: Общая органическая химия, пер. с англ., т. 7, М., 1984. с. 42-59;
Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. I, Oxf, 1982, p.
156-223. А. С. Перегудов.
, C=S и др., см. Гриньяра реакция
, Иоцича реакция
.
Соед. R2Mg - бесцв. твердые в-ва, обычно разлагающиеся при нагр. без плавления, для нек-рых R2Mg известны т-ры плавления. Плохо раств. в насыщ. углеводородах, лучше - в бензоле. Обычно кристаллизуются из полярных сред в виде комплексов с р-рителем составов 1:1 или 1:2, однако в отличие от RMgHal р-ритель м. б. легко удален в вакууме. В кристаллич. состоянии R2Mg(R = CH3, С2Н5) имеют структуру линейных полимеров с мостиковыми алкильными группами. В среде углеводородов R2Mg представляют собой димеры или тримеры, в эфире или ТГФ - сольватированные мономеры, однако при высоких концентрациях R2Mg возможна их ассоциация. Связь Mg—С в растворенных R2Mg обычно ковалентная, однако в гексаметаполе она существенно ионизирована. В эфирном р-ре (C5H5)2Mg существует как контактная ионная пара.
Наиб. термически стабильно соед. [(CH3)2Mg]n, к-рое разлагается выше 220 °С с выделением СН4 и образованием полимерного (CH2Mg)n. Выше 300°С при разложении образуются Н2 и MgC2. Др. R2Mg, где R - нормальный алкил, разлагаются при 170-210°С до MgH2 и алкенов, при
R = вторичный и третичный алкил - при более низких т-рах. По хим. св-вам R2Mg в целом аналогичны RMgHal, однако часто хим. р-ции R2Mg протекают с большими скоростями. Таковы, напр., р-ции с О2, СО2, Н2, р-ции с орг. соед. и др. Однако наблюдаются и нек-рые различия. Напр., 1,2-присоединения R2Mg к a,b-ненасыщенным кетонам, тогда как для RMgHal характерно 1,4-присоединение.
Получают R2Mg: осаждением диоксаном из эфирного р-ра RMgHal; р-цией с ртутьорг. соед. - R2Hg + Mg : R2Mg + Hg; (C5H5)2Mg м. б. получен при 500°C из С5Н6 и металлич. Mg.
Соед. типа RMgOR - кристаллы, нелетучи; плохо раств. в насыщ. углеводородах, раств. в ароматич. р-рителях. Образуют комплексы с эфиром, из к-рых он легко удаляется в вакууме. В твердом состоянии представляют собой линейные олигомеры, в р-ре образуют ассоциаты с мостиковыми атомами О. При пиролизе RMgOR при 200-340°С образуются алканы, алкены и MgO. Присоединяются к группе С=О альдегидов и кетонов, но менее легко, чем R2Mg, давая большее кол-во побочных продуктов. Получают их алкоголизом R2Mg.
Соед. типа RMgX, где X = SR, NRR, получают действием RSH или RRNH на R2Mg в эфире при низких т-рах.
М.с., образованные путем переноса электрона от Mg к ароматич. и др. ненасыщ. системам, менее изучены по сравнению с аналогичными соед. щелочных металлов.
М.с. в осн. используют в орг. синтезе и для получения металлоорг. соединений. В пром-сти М.с. в смеси с др. металлоорг. соед. применяют как катализаторы полимеризации.
Лит.: Общая органическая химия, пер. с англ., т. 7, М., 1984. с. 42-59;
Comprehensive organometallic chemistry, ed. by G. Wilkinson, v. I, Oxf, 1982, p.
156-223. А. С. Перегудов.
|

