МАКСИМАЛЬНАЯ РАБОТА РЕАКЦИИ
, работа, к-рая производится термодинамич. системой при протекании в ней обратимой хим. р-ции. М. р. р. Wмакс складывается из
работы по преодолению внеш. давления р - мех. работы
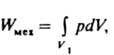
где V - объем системы, и работы, к-рая не сопровождается изменением объема системы и наз. максимальной полезной работой р-ции Wмакс (работа по преодолению электрич., магн. сил, работа пластич. деформации и т. п.). Последнюю рассматривают обычно как собственно работу хим. процесса, связанную с изменением состава системы. Из термодинамич. ур-ний, справедливых для любых обратимых процессов, следует, что бесконечно малое кол-во работы равно:
dWмакс = dWмакс + pdV = - dF - SdT, (1)
где F - энергия Гельмгольца, S - энтропия, Т - абс. т-ра. При постоянной т-ре (dT = 0)
dWмакс = - dF; Wмакс = - DFT, (2)
т. е. в изотермич. процессе М. р. р. равна убыли энергии Гельмгольца. При постоянных т-ре и объеме (dT = 0, dV = 0), т. е. в изохорно-изотермич. процессе, убыль энергии Гельмгольца определяет не М. р. р., а макс. полезную работу:
dWмакс = - dFT,V ; Wмакс = - DFT,V. (3)
В случае изобарно-изотермич. процесса (dT = 0, dp = 0) макс. полезная работа равна убыли энергии Гиббса:
dWмакс = - dGT,p; Wмакс = - DGT,p. (4)
Для того чтобы система в результате хим. р-ции могла совершать полезную работу, необходимо выполнение след. неравенств:
DFT,V < 0; DGT,p < 0.
Допустим, что в системе происходит хим. р-ция
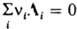 ,
где ni - стехиометрич. коэф. в-ва Ai (ni > 0 для продуктов р-ции, ni < 0 для исходных в-в). Если р-ция прошла один пробег (изменение числа молей в-ва А составляет ni) и система столь велика, что состояние ее при этом практически не изменится, то для процесса при Т,V = const
,
где ni - стехиометрич. коэф. в-ва Ai (ni > 0 для продуктов р-ции, ni < 0 для исходных в-в). Если р-ция прошла один пробег (изменение числа молей в-ва А составляет ni) и система столь велика, что состояние ее при этом практически не изменится, то для процесса при Т,V = const 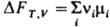 ; для процесса при
; для процесса при 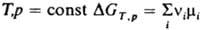 , где
mi - хим. потенциал в-ва Аi; для обоих процессов
, где
mi - хим. потенциал в-ва Аi; для обоих процессов

При хим. равновесии 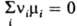 и система не способна совершать полезную работу. Если
и система не способна совершать полезную работу. Если 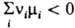 , полезная работа совершается при протекании р-ции в прямом направлении (Wмакс > 0); при
, полезная работа совершается при протекании р-ции в прямом направлении (Wмакс > 0); при 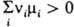 р-ция протекает в обратном
направлении (Wмакс < 0). Величина
р-ция протекает в обратном
направлении (Wмакс < 0). Величина 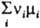 наз. сродством
реакции или химическим сродством, и, согласно (5), макс. полезная работа р-ции равна хим. сродству со знаком минус. В совр. физ.-хим. литературе понятие сродства р-ции используется гораздо чаще, чем понятие макс. полезной работы р-ции.
Требование обратимого протекания процесса в химически неравновесной системе, к-рое выдвигается при записи выражений (1)-(5), может быть выполнено лишь в том случае, если к системе приложена внеш. сила, компенсирующая движущую силу хим. взаимодействия, и р-ция протекает практически с бесконечно малой скоростью. Рассмотрим, напр., гальванич. элемент, в к-ром за счет хим. р-ции осуществляется полезная работа (электрическая). Он работает обратимо, если его эдс скомпенсирована внешней эдс. При этом электроды находятся в равновесии с р-ром, хим. р-ции и связанные с ними процессы переноса заряда происходят бесконечно медленно. Электрич. работа гальванич. элемента Wмакс = — zFE, где z - число зарядов,
переносимых при р-ции (величины Wмакс и z относят к одному пробегу р-ции), F - постоянная Фарадея, Е - эдс элемента.
Макс. полезная работа р-ции Wмакс, как и хим. сродство, зависит от состава реакц. смеси, т-ры и давления (в случае конденсированных систем влияние последнего обычно мало). Имеется след. связь между Wмакс и константой равновесия р-ции Ка:
наз. сродством
реакции или химическим сродством, и, согласно (5), макс. полезная работа р-ции равна хим. сродству со знаком минус. В совр. физ.-хим. литературе понятие сродства р-ции используется гораздо чаще, чем понятие макс. полезной работы р-ции.
Требование обратимого протекания процесса в химически неравновесной системе, к-рое выдвигается при записи выражений (1)-(5), может быть выполнено лишь в том случае, если к системе приложена внеш. сила, компенсирующая движущую силу хим. взаимодействия, и р-ция протекает практически с бесконечно малой скоростью. Рассмотрим, напр., гальванич. элемент, в к-ром за счет хим. р-ции осуществляется полезная работа (электрическая). Он работает обратимо, если его эдс скомпенсирована внешней эдс. При этом электроды находятся в равновесии с р-ром, хим. р-ции и связанные с ними процессы переноса заряда происходят бесконечно медленно. Электрич. работа гальванич. элемента Wмакс = — zFE, где z - число зарядов,
переносимых при р-ции (величины Wмакс и z относят к одному пробегу р-ции), F - постоянная Фарадея, Е - эдс элемента.
Макс. полезная работа р-ции Wмакс, как и хим. сродство, зависит от состава реакц. смеси, т-ры и давления (в случае конденсированных систем влияние последнего обычно мало). Имеется след. связь между Wмакс и константой равновесия р-ции Ка:
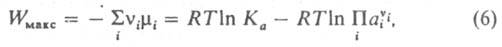
где ai - термодинамич. активность в-ва Ai, Ka = Pi an.
Температурная зависимость М. р. р. определяет калорич. характеристики р-ции. В тех случаях, когда р-ция происходит при постоянном давлении (в изобарных условиях), выполняется соотношение:
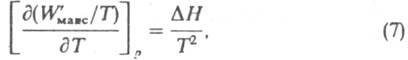
где 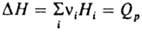 - теплота процесса, равная изменению
энтальпии системы при одном пробеге р-ции, Hi - парциальная молярная энтальпия в-ва. В изохорных условиях, т. е. при постоянном объеме системы, температурная зависимость М. р. р. имеет вид:
- теплота процесса, равная изменению
энтальпии системы при одном пробеге р-ции, Hi - парциальная молярная энтальпия в-ва. В изохорных условиях, т. е. при постоянном объеме системы, температурная зависимость М. р. р. имеет вид:
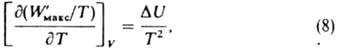
где DU = QV - тепловой эффект, равный изменению внутр. энергии системы при одном пробеге р-ции.
Лит.: Карапетьянц М. X., Химическая термодинамика, 3 изд., М., 1975, с. 101-07, 390-400. Н. А. Смирнова.
|

