МЕЖМОЛЕКУЛЯРНЫЕ ВЗАИМОДЕЙСТВИЯ
,
взаимод. молекул между собой, не приводящее к разрыву или образованию новых
хим. связей. М. в. определяет отличие реальных газов от идеальных, существование
жидкостей и мол. кристаллов. От М. в. зависят мн. структурные, спектральные,
термодинамич., теплофиз. и др. св-ва в-в. Появление понятия М. в. связано с
именем Й. Д. Ван-дер-Ваальса, к-рый для объяснения св-в реальных газов и жидкостей
предложил в 1873 ур-ние состояния, учитывающее М.в. (см. Ван-дер-Ваальса уравнение
). Поэтому силы М.в. часто называют ван-дер-ваальсовыми.
Виды М.в. Основу
М.в. составляют кулоновские силы взаимод. между электронами и ядрами одной молекулы
и ядрами и электронами другой. В экспериментально определяемых св-вах в-ва проявляется
усредненное взаимод., к-рое зависит от расстояния R между молекулами,
их взаимной ориентации, строения и физ. характеристик (ди-польного момента,
поляризуемости
и др.). При больших R, значительно превосходящих линейные
размеры l самих молекул, вследствие чего электронные оболочки молекул
не перекрываются, силы М. в. можно достаточно обоснованно подразделить на три
вида-электростатические, поляризационные (индукционные) и дисперсионные. Электростатич.
силы иногда называют ориентационными, однако это неточно, поскольку взаимная
ориентация молекул может обусловливаться также и поляризац. силами, если молекулы
анизотропны.
При малых расстояниях между
молекулами (R ~ l) различать отдельные виды М. в. можно лишь приближенно,
при этом, помимо названных трех видов, выделяют еще два, связанные с перекрыванием
электронных оболочек, - обменное взаимодействие и взаимодействия, обязанные
переносу электронного заряда. Несмотря на нек-рую условность, такое деление
в каждом конкретном случае позволяет объяснять природу М. в. и рассчитать его
энергию.
Э н е р г и я э л е к т
р о с т а т и ч е с к о г о в з а и м о д е й с т в и я Vэл-ст
представляет собой энергию кулоновского взаимод., вычисленную в предположении,
что распределение зарядовой плотности отвечает изолир. молекулам (R = 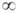 ).
В общем случае электрич. потенциал вокруг молекулы изменяется не только по абс.
величине, но и по знаку. Если взаимная ориентация двух молекул такова, что область
положит. потенциала одной из них приблизительно совпадает с областью, в к-рой
локализован отрицат. заряд другой, то Vэл-ст < 0, т. е.
электростатич. взаимод. молекул ведет к их притяжению. При R>>l энергия
Vэл-ст становится равной сумме энергий взаимод. мультиполей
(диполей, квадруполей и т. д.); для полярных молекул главный вклад дает обычно
диполь-дипольное взаимодействие. Его энергия Vдип-дип может
иметь разный знак в зависимости от ориентации диполей. При ориентации молекул
А и В, соответствующей минимуму энергии взаимод., Vдип-дип
= — 2pApB/R3, где pА
и рB - дипольные моменты молекул А и В соответственно. В газовой
фазе, где молекулы почти свободно вращаются, более вероятны такие их взаимные
ориентации, к-рые отвечают притяжению диполей. При этом средняя энергия взаимод.
равна:
).
В общем случае электрич. потенциал вокруг молекулы изменяется не только по абс.
величине, но и по знаку. Если взаимная ориентация двух молекул такова, что область
положит. потенциала одной из них приблизительно совпадает с областью, в к-рой
локализован отрицат. заряд другой, то Vэл-ст < 0, т. е.
электростатич. взаимод. молекул ведет к их притяжению. При R>>l энергия
Vэл-ст становится равной сумме энергий взаимод. мультиполей
(диполей, квадруполей и т. д.); для полярных молекул главный вклад дает обычно
диполь-дипольное взаимодействие. Его энергия Vдип-дип может
иметь разный знак в зависимости от ориентации диполей. При ориентации молекул
А и В, соответствующей минимуму энергии взаимод., Vдип-дип
= — 2pApB/R3, где pА
и рB - дипольные моменты молекул А и В соответственно. В газовой
фазе, где молекулы почти свободно вращаются, более вероятны такие их взаимные
ориентации, к-рые отвечают притяжению диполей. При этом средняя энергия взаимод.
равна:
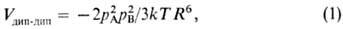
где Т-абс. т-ра,
k-постоянная Больцмана. При фиксированной ориентации молекул, напр. в
твердом теле, Vдип-дип слабо зависит от Т и изменяется
пропорционально R-3
. Если взаимодействующие
молекулы обладают квадрупольными или более высокого порядка электрич. моментами,
в выражение для Vэл-ст входят также слагаемые, отвечающие
взаимод. этих мультиполей. По этой причине, в частности, энергетически наиб.
выгодная ориентация молекул может отличаться от оптимальной ориентации их дипольных
моментов.
П о л я р и з а ц и о н
н о е в з а и м о д е й с т в и е обусловлено
деформацией электронной оболочки одной молекулы под
влиянием электрич. поля другой, что всегда приводит к понижению энергии (притяжению
молекул). При больших расстояниях между нейтральными молекулами главный вклад
в поляризац. энергию Vпол дает взаимод. постоянного диполя
полярной молекулы с индуцированным диполем другой. Поэтому это взаимод. иногда
называют индукционным. Согласно ф-ле Дебая,
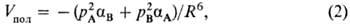
где aА и aB-
средние статич. поляризуемости молекул А и В соответственно. Если поляризуемости
молекул анизотропны, то в выражении для Vпол появляются дополнит.
члены, зависящие от взаимной ориентации молекул.
М.в., связанное с переносом
электронного заряда с одной молекулы на другую, близко по физ. смыслу к поляризац.
М. в. Перенос заряда происходит при перекрывании электронных оболочек молекул,
если их сродство к электрону различно. Перенос заряда можно наглядно рассматривать
как "далеко зашедшую" поляризацию, однако энергия М. в., связанного
с переносом заряда, |V|п.з по своему абс. значению существенно
меньше | Vпол | и очень быстро (экспоненциально) стремится
к нулю с увеличением R. Строго разделить вклады поляризации и переноса
заряда в энергию М. в. затруднительно, поэтому часто вычисляют суммарную величину,
обозначаемую просто Vпол.
Дисперсионное М.в. определяется
корреляцией движения электронов двух взаимодействующих молекул, в результате
чего среднее расстояние между электронами этих молекул несколько увеличивается.
Это приводит к уменьшению энергии их взаимодействия, т.е. к притяжению молекул.
Дисперсионное взаимод. имеет универсальный характер: оно существует между любыми
молекулами. Энергия дисперсионного взаимод. Vдисп двух
атомов или сферически симметричных молекул при R>>l приближенно
описывается ф-л о й Л о н д о н а:

где IА
и IB-потенциалы ионизации молекул А и В соответственно. Для
молекул иной формы зависимость Vдисп от R и от их физ.
характеристик оказывается более сложной (подробнее см. Дисперсионное взаимодействие
).
При близких расстояниях (R ~ l) дисперсионное М. в. усложняется
и обычно наз. корреляционным. Его энергия V м.б. вычислена методами квантовой
химии. При сверхдальних расстояниях между молекулами (порядка 100 нм) на их
взаимод. начинает сказываться конечность скорости распространения электрич.
сигнала (скорости света), в силу чего заряды взаимод. не мгновенно, а с нек-рым
запаздыванием; Vдисп оказывается пропорциональным R-7
.
Энергия о б м е н н о г
о в з а и м о д е й с т в и я молекул Vобм обусловлена тем,
что в соответствии с принципом Паули в одном и том же квантовом состоянии не
могут находиться два электрона с одинаковыми спинами. Вследствие этого электронная
плотность в пространстве между молекулами при перекрывании их электронных оболочек
уменьшается (подробнее см. Обменное взаимодействие
).
Полная энергия М.в., или
межмолекулярный потенциал, V приблизительно равняется сумме вкладов отдельных
видов М.в.:
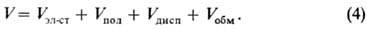
При R >> l
последний член обращается в нуль, а первые три можно вычислить по ф-лам (1)-(3).
При малых расстояниях между молекулами эти ф-лы, строго говоря, не пригодны
для количеств. определения
V, однако во мн. случаях они дают правильную качеств. картину М. в. Если
обе или одна из молекул имеет электрич. заряд, то ф-ла (4) остается в силе,
однако каждое слагаемое изменится и будет отражать действие дополнит. заряда
одной молекулы на другую.
При нек-ром расстоянии
R = Re и подходящей взаимной ориентации молекул А и В силы
притяжения становятся равными силам отталкивания, потенциал V(R)имеет
минимум и система находится в равновесии. Если при этом глубина потенц. ямы
больше нулевой энергии межмол. колебания, то молекулы образуют устойчивый комплекс
(ассоциат), что подтверждается спектральными данными. Расчеты показывают, что
в тех случаях, когда молекулы полярны (или имеют электрич. заряд), наибольший
по абс. величине вклад в энергию притяжения при R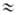 Re
дает Vэл-ст. Величина Vобм того же порядка,
но она приводит к отталкиванию молекул. Вклады Vпол и
V дисп составляют при этом, как правило, от 20 до 40% суммарной
энергии притяжения; Vдисп(Vкорр ) играет
существ. роль только для М.в. неполярных или слабо полярных молекул (с малым
дипольным моментом). Типичная зависимость от R полной энергии взаимод.
полярных молекул и отдельных ее вкладов приведена на рис. 1 для димера воды.
Re
дает Vэл-ст. Величина Vобм того же порядка,
но она приводит к отталкиванию молекул. Вклады Vпол и
V дисп составляют при этом, как правило, от 20 до 40% суммарной
энергии притяжения; Vдисп(Vкорр ) играет
существ. роль только для М.в. неполярных или слабо полярных молекул (с малым
дипольным моментом). Типичная зависимость от R полной энергии взаимод.
полярных молекул и отдельных ее вкладов приведена на рис. 1 для димера воды.
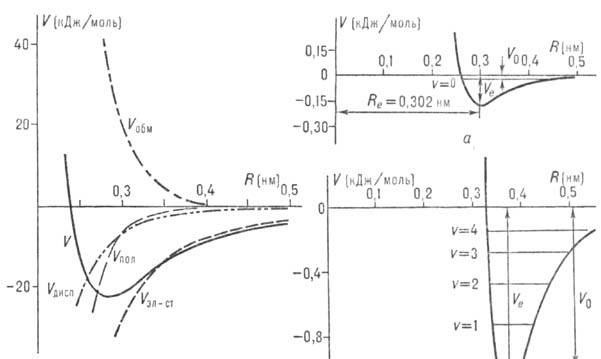

В зависимости от энергии
диссоциации различают слабые и сильные мол. комплексы. Наименее устойчивые комплексы,
наблюдаемые при низких т-рах, образуют атомы инертных газов. Так, энергия диссоциации
комплекса Не•Ne равна 0,02 кДж/моль, комплекса Аr•Аr-1,0 кДж/моль (рис. 2).
Низкую энергию диссоциации (1-10 кДж/моль) имеют также комплексы неполярных
молекул, напр. (Н2)2, (N2)2, (С2Н4)2,
бензол.(Наl)2 и др. Более устойчивые комплексы образуются
полярными молекулами. Примером очень прочного ассоциата может служить C5H5N•AlBr3,
энергия диссоциации к-рого равна 190 кДж/моль, т.е. сравнима с энергией хим.
связи. В газовой фазе существуют не только димеры (HF)2, (H2O)2,
HF•H2O и др., но и комплексы из трех и большего числа молекул, напр.
(HF)3, (HF)6, (H2O)3, (NH3)3.
Для таких ассоциатов циклич. структура, как правило, более устойчива, чем цепочечная.
Особую группу образуют ион-молекулярные комплексы, напр. Na+ •(NH3)m,
F-•(H2O)m (m = 1, 2, ..., 6),
для к-рых энергия отрыва одного лиганда составляет от 80 до 150 кДж/моль.
Специфические межмолекулярные
взаимодействия. Частный случай М.в.-водородная связь
. От М.в. полярных
молекул, не содержащих атомов Н, она в целом не отличается
ни по энергии диссоциации (10-100 кДж/моль), ни по относит. величине разл.
вкладов в межмол. потенциал; во всех случаях главный вклад в энергию притяжения
дает Vэл-ст (кривая на рис. 1 относится к Н-связи НО—Н ...ОН2).
Специфично для водородной связи сильное взаимод. разл. колебат. степеней свободы
в комплексах. Это приводит, в частности, к длинноволновому смещению и уширению
ИК полосы АН-группы (напр., О—Н).
Важный вид мол. комплексов
- комплексы с переносом заряда. В их основном квантовом состоянии перенос электронного
заряда не более, чем при обычных видах М. в., однако при возбуждении происходит
значит. перенос заряда от одной молекулы (донора) к другой (акцептору); в спектре
поглощения появляется дополнит. полоса в ближней УФ области. Пример -мол. комплексы
иода (акцептор) с аминами NR3. ИК спектры комплексов с переносом
заряда сходны со спектрами комплексов с водородной связью.
Мол. комплексы образуются
и при т. наз. резонансном взаимодействии. Оно возникает, как правило, между
одинаковыми молекулами, если сначала (при R >> Re)одна из них находится в возбужденном состоянии, а другая-в основном состоянии.
При сближении молекул возникают два возбужденных уровня энергии, смещенных в
разные стороны по отношению к энергии исходного возбужденного состояния. Величину
этого сдвига называют резонансной энергией. Энергия ниж. уровня часто имеет
минимум при нек-ром R, что соответствует образованию квазиравновесного
комплекса (димера) в возбужденном состоянии (рис. 3).
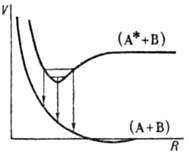
Рис. 3. Кривые потенциальной
энергии V для эксимера; (А + В)-основное состояние, (А* + В)-первое электронно-возбужденное
состояние. Стрелки указывают пути излучат.
перехода из верхнего состояния в нижнее.
Такой комплекс наз. эксимером.
Эксимеры с временами жизни порядка 10-8 с наблюдаются, напр., в р-рах
красителей. Сходное расположение уровней энергии может возникать и при сближении
неодинаковых молекул; образующиеся при этом возбужденные комплексы наз. эксип-лексами.
Многочастичные М.в.
Для системы, состоящей более чем из двух молекул, полная энергия М. в. отличается
от суммы парных взаимодействий (неаддитивность). Так, при взаимод. трех частиц
А, В, С энергию М.в. можно записать в след. виде:

где первые три слагаемых
представляют собой энергии парных М.в., а последний член-энергию тройного М.в.,
к-рое обусловливает отступление от аддитивности. Влияние многочастичных взаимод.
на св-ва в-в обнаруживается экспериментально даже в случае инертных газов. Напр.,
равновесные расстояния различны в димерах (в газовой фазе) и в кристаллах вследствие
неаддитивности обменной и дисперсионной энергий (электростатич. энергия М.в.
всегда аддитивна). Наиб. заметно влияние многочастичных взаимод. для комплексов
полярных молекул и для ион-молекулярных комплексов. В них неаддитивность М.
в. обусловливают гл. обр. поляризационные силы, причем абс. величина и знак
отклонения от аддитивности в энергии зависят от взаимного расположения частиц.
Механизм многочастичного взаимод. полярных молекул можно пояснить на примере
воды. При последоват. расположении трех молекул
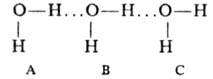
молекула В под влиянием
диполя молекулы А поляризуется и ее атомы Н приобретают дополнит. положит. заряд.
Благодаря этому взаимод. В с С становится несколько более сильным, чем при парном
взаимодействии. При переходе от газовой фазы, содержащей димеры А.В,
к конденсированной фазе величины Re уменьшаются, a |V| возрастают. Наряду с многочастичным взаимод. в этот эффект дает вклад также
парное диполь-дипольное взаимод. молекул, принадлежащих разным димерам. Установлено
экспериментально, что, напр., расстояние Re (F...F)в
кристаллах HF меньше на ~ 10%, а |V| больше на ~ 39%, чем в газовой фазе;
для воды соотв. значения составляют 6% и ~50%.
Модельные межмолекулярные
потенциалы. При больших расстояниях между молекулами (R >>
l)зависимость потенциала парного М.в. от R определяют методами возмущений теории
, напр. ф-лы (1)-(3). При расстояниях, близких к равновесному Re,
зависимость V от R м. б. определена численными методами квантовой
химии. Вместе с тем для решения мн. практич. задач важно знать аналит. зависимость
V(R). Предложено неск. разл. модельных ф-ций. Эти ф-ции должны
удовлетворять трем условиям общего характера: 1) при R =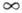 V= 0, 2) при R = Re V(R)имеет минимум, 3) при R < Re V быстро возрастает (отталкивание). Параметры, входящие
в выражение для модельного потенциала, выбирают так, чтобы вычисленные с его
помощью значения физ. величин, зависящих от М. в., совпадали или были достаточно
близки к значениям, определяемым экспериментально.
V= 0, 2) при R = Re V(R)имеет минимум, 3) при R < Re V быстро возрастает (отталкивание). Параметры, входящие
в выражение для модельного потенциала, выбирают так, чтобы вычисленные с его
помощью значения физ. величин, зависящих от М. в., совпадали или были достаточно
близки к значениям, определяемым экспериментально.
Одним из распространенных
потенциалов является п от е н ц и а л М о р с а (М о р з е):

В него входят три эмпирич.
параметра: Ve, b и Re. Параметр Ve
равен глубине потенц. ямы, связанной с энергией диссоциации V0
мол. комплекса соотношением: Ve = V0
+ 1/2 hv, где 1/2
hv - нулевая энергия межмол. колебаний (v- частота этих колебаний,
h - постоянная Планка) (см. рис. 2); параметр b определяется из условия,
чтобы ф-ция (5) давала правильное значение частоты v; расстояние Re
можно определить, напр., из вращат. микроволнового спектра ассоциа-та или
одним из дифракц. методов.
На больших расстояниях
R ф-ция (5) экспоненциально стремится к нулю, тогда как в действительности
потенциал М. в. убывает по степенному закону [согласно ф-лам (1)-(3) как R-6
].
Эту закономерность отражает п о т е н ц и а л Л е н-н а р д-Д ж о н с а:

Согласно (6), энергия отталкивания
возрастает с уменьшением R пропорционально R-12. Квантовохим.
расчеты показывают, однако, что энергия должна возрастать приблизительно экспоненциально,
как в потенциале Морса. Правильному поведению при R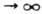 и R
и R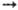 0
удовлетворяет п о т е н ц и а л Б у к и н г е м а:
0
удовлетворяет п о т е н ц и а л Б у к и н г е м а:
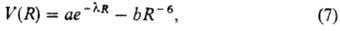
содержащий эмпирич. параметры
а, b и l.
Приведенные модельные потенциалы
не учитывают взаимной ориентации взаимод. частиц. Для расчета взаимод. многоатомных
молекул произвольной формы Т. Хиллом, а затем А.И.Китайгородским был разработан
метод атом-атомных потенциалов. Согласно этому методу, межмол. потенциал V записывается в виде суммы потенциалов Vab парных взаимод.
каждого атома а одной молекулы с каждым атомом b другой, причем
Vab выражается к.-л. простой аналит. ф-цией, напр. потенциалом
Букингема (7). Для каждой пары валентно не связанных атомов из эксперимента
определяют эффективные значения входящих в Vab параметров,
к-рые предполагаются универсальными, не зависящими от того, в какие молекулы
входит данная пара атомов. Метод применим к мол. кристаллам, полимерам, сложным
мол. комплексам. С его помощью рассчитывают конформации мол. изомеров, взаимные
расположения молекул
в элементарной ячейке, теплоты сублимации кристаллов и др. Приближенность метода
заключается, в частности, в том, что многочастичные взаимод. учитываются только
косвенно, выбором эффективных значений параметров в атом-атомном потенциале.
Существует ряд методов,
позволяющих в простых случаях определять межмол. потенциалы непосредственно
из экспе-рим. данных, не прибегая к модельным потенциалам, напр. по вращательно-колебат.
спектрам мол. комплексов, по рассеянию молекул при столкновениях или по данным
о вязкости газов.
М.в. изучают разл. физ.
методами, основные из к-рых-молекулярных пучков метод
, дифракционные методы
,
в частности газовая электронография, масс-спектрометрия по-выш. давления,
ЯМР, микроволновая спектроскопия, ЯКР, колебат. спектроскопия (инфракрасная
и комбинац. рассеяния), вакуумная УФ спектроскопия; изучение температурных зависимостей
вириальных коэф., коэф. вязкости, диффузии, теплопроводности и др. Важную роль
в исследовании М. в. играют расчетные методы квантовой химии
.
Лит.: Гиршфельдер
Дж., Кертисс Ч., Бэрд Р., Молекулярная теория газов и жидкостей, пер. с англ.,
М., 1961; Межмолекулярные взаимодействия; от двухатомных молекул до биополимеров,
пер. с англ., М., 1981; Каплан И. Г., Введение в теорию межмолекулярных взаимодействий,
М., 1982; Molecular interactions, ed. by H. Ratajczak, W.J. Orville-Thomas,
v. 1-3, Chichester, 1980-82.
Н.Д. Соколов.
|

