МЕТАЛЛИЧЕСКАЯ СВЯЗЬ
,
хим. связь, обусловленная взаимод. электронного газа (валентные электроны)
в металлах с остовом положительно заряженных ионов кристаллич. решетки. Идеальная
модель М.с. отвечает образованию частично заполненных валентными электронами
металла зон энергетич. уровней (см. Твердое тело
), наз. зонами проводимости.
При сближении атомов, образующих металл, атомные орбитали валентных электронов
переходят в орбитали, делокализованные по кристаллич. решетке аналогично делокализованным
p-орбиталям сопряженных соединений. Количественно описать М.с. можно только
в рамках квантовой механики, качественно образование М.с. можно понять исходя
из представлений о ковалентной связи
.
При сближении двух атомов
металла, напр. Li, образуется ковалентная связь, при этом происходит расщепление
каждого энергетич. уровня валентного электрона на два. Когда N атомов
Li образуют кристаллич. решетку, перекрывание электронных облаков соседних атомов
приводит к тому, что каждый энергетич. уровень валентного электрона расщепляется
на N уровней, расстояния между к-рыми из-за большой величины N настолько
малы, что их совокупность может считаться практически непрерывной зоной энергетич.
уровней, имеющей конечную ширину. Поскольку каждый атом участвует в образовании
большего числа связей, чем, напр., в двухатомной молекуле при том же числе валентных
электронов, то минимум энергии системы (или максимум энергии связи) достигается
при расстояниях больших, чем в случае двухцентровой связи в молекуле. Межатомные
расстояния в металлах заметно больше, чем в соед. с ковалентной связью (металлич.
радиус атомов всегда больше ковалентного радиуса), а координац. число (число
ближайших соседей) в кристаллич. решетках металлов обычно 8 или больше 8. Для
наиб. часто встречающихся кристаллич. структур координац. числа равны 8 (объемноцентрир.
кубич.), 12 (гранецентрир. кубическая и гексаген. плотно-упакованная). Расчеты
параметров металлич. решеток с использованием ковалентных радиусов дают заниженные
результаты. Так, расстояние между атомами Li в молекуле Li2 (ковалентная
связь) равно 0,267 нм, в металле Li-0,304 нм. Каждый атом Li в металле имеет
8 ближайших соседей, а на расстоянии, в 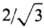 раз большем,-еще 6. Энергия связи в расчете на один атом Li в результате увеличения
числа ближайших соседей увеличивается с 0,96.10-19 Дж
для Li2 до 2,9.10-19 Дж для кристаллич. Li.
раз большем,-еще 6. Энергия связи в расчете на один атом Li в результате увеличения
числа ближайших соседей увеличивается с 0,96.10-19 Дж
для Li2 до 2,9.10-19 Дж для кристаллич. Li.
Во мн. металлах М.с. между
атомами включает вклады ионной или ковалентной составляющей. Особенности М.
с. у каждого металла м. б. связаны, напр., с электростатич. отталкиванием ионов
друг от друга с учетом распределения электрич. зарядовое них, с вкладом в образование
связи электронов внутр. незаполненных оболочек переходных металлов, с корреляцией
движения электронов в электронном газе и нек-рыми др. причинами.
М. с. характерна не только
для металлов и их сплавов, но и для металлических соединений
(см. также Интерметал-лиды), она сохраняется не только в твердых кристаллах, но
и в расплавах и в аморфном состоянии.
Лит.: Блейкмор Дж.,
Физика твердого тела, пер. с англ., М., 1988. См. также лит
. при ст. Металлы
.
Ю. С. Старк.
|

