МЕТАНСУЛЬФОХЛОРИД
(хлорангидрид
метансульфоки-слоты, мезилхлорид) CH3SO2Cl, мол.м. 114,56;
желтая жидкость; т.пл. -32°С, т.кип. 164°С; d2020
1,485; nD20 1,4518. Раств. в орг. р-рителях,
не раств. в воде (медленно гидролизуется). Легко гидролизуется горячей водой.
При взаимод. М. с CH3SO3Ag при 160 °С образуется ангидрид
метансульфо-кислоты (CH3SO2)2O, с сухим ZnF2
при 160-170 °С-CH3SO2F, с спиртовым р-ром NН3-метансульфамид,
с первичными или вторичными аминами - соответствующие сульфамиды, напр.:
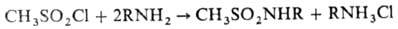
Обработка спиртов М. в
пиридине при 0°С приводит к образованию эфиров метансульфокислоты (мезилатов).
Синтез мезилатов, катализируемый третичными аминами, протекает через образование
реакционноспособного суль-фена:
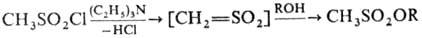
Первичные спиртовые группы
реагируют с М. быстрее вторичных, что позволяет широко использовать данную р-цию
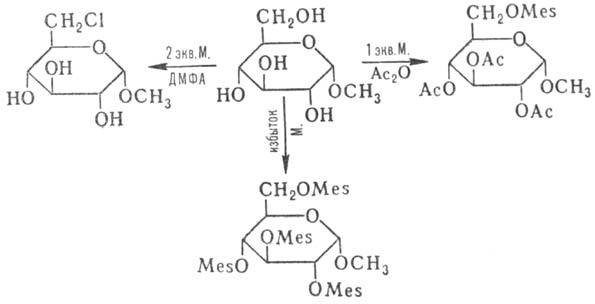
в химии углеводов и стероидов. Так, метил-a, D-глю-копиранозид с эквимолярным
кол-вом М. образует 6-О-ме-зилпроизводное, с избытком М.-2,3,4,6-тетрамезильное
производное; р-ция метил-a, D-глюкопиранозида с двумя эквивалентами М. в ДМФА
приводит к селективному замещению первичной спиртовой группы на атом хлора (Mes
= CH3S02):
М. используют в орг. синтезе
для элиминирования ви-цинальных заместителей I и ОН; напр., р-ция М. с иод-гидроксилактоном
(ф-ла I) в сухом пиридине приводит к ненасыщ. лактону (II):
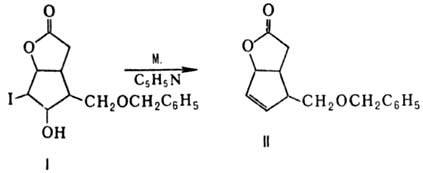
Эта р-ция является ключевой
стадией синтеза простаглан-динов А. При обработке аллиловых спиртов М. в присут.
LiCl в смеси ДМФА и 2,4,6-коллидина образуются аллил-хлориды. В р-циях Фриде
ля - Крафтса М. дает соответствующие метилсульфоны, напр.:
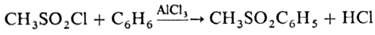
М. используют для защиты
групп ОН в полипептидах, содержащих остатки гидроксисодержащих аминокислот.
М. получают обработкой
техн. CH3SO3H тионилхлори-дом, а также РСl5.
М.-лакриматор, раздражает
кожу; т.воспл. 110°С.
Лит.: Физер Л.,
Физер М., Реагенты для органического синтеза, пер. с англ., М., 1970-78, т.
2, с. 250-53; т. 5, с. 286-87; т. 7, с. 324-25.
А. А. Дудинов.
|

