МЕТИЛОВЫЙ СПИРТ
(метанол,
карбинол, древесный спирт) СН3ОН, мол.м. 32,04. Длина связей (им):
1,4214 b b0,0017 (С—О), 1,0937 b0,0028 (С—Н), 0,9630 b
0,0079 (О—Н); валентные углы: 108°32b8 (НСН), 108°02b24
(СОН); угол 9 (между осью симметрии группы СН3 и направлением связи
С—О) 3°16b18.
М. с.-бесцв., легкоподвижная
жидкость с запахом, аналогичным запаху этилового спирта; т. пл. — 93,9 °С,
т. кип. 64,509°С; d204 0,7914; nD20
1,3286; h 0,584 МПа.с (20°С), давление паров (кПа): 11,8
(20 °С), 32,5 (40 °С), 77,3 (60 °С), 320,65 (100 °С); g 22,55
мН/м (20 °С), 21,69 мН/м (30 °С); tкрит 240,10С,
pкрит 7,977 МПа, dкpит272 кг/м3;
m 0,57.10-30 Кл.м; e 32,63 (25 °С); DH0oбр
-238,9 кДж/моль (жидкость), -201,0 b b0,6кДж/моль (газ), DH0сгор,
-715 кДж/моль, DH0исп 37,9 b 0,2 кДж/моль,
DHпл 3,17 кДж/моль; теплопроводность 202,3.10-3
Вт/(м.К) (жидкость), 150,7.10-4 Вт/(м.К)
(газ); С0р 44,129 Дж/(моль.К).
Теплоемкость для т-р 0-50 °С определяют по ур-нию Ср =
2,3815 + 0,0586.t [кДж/(кг.К)], в газообразном
состоянии для т-р 0-1200°С-по ур-нию Ср = 25,0429 + 50,3249.10-3T+
59,1298.10-6 Т2-45,245.10-9
Т3 [кДж/(моль.К)].
СВОЙСТВА ВОДНЫХ РАСТВОРОВ
МЕТИЛОВОГО СПИРТА В ЗАВИСИМОСТИ ОТ ЕГО КОНЦЕНТРАЦИИ
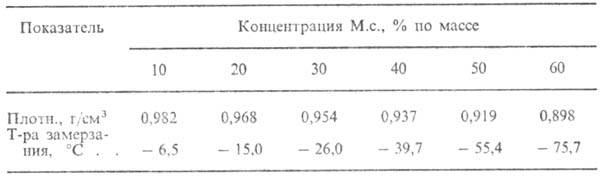
М.с. смешивается во всех
соотношениях с водой (св-ва водных р-ров М.с. приведены в табл.), спиртами,
ацетоном, бензолом; образует азеотропные смеси с ацетоном (т.кип. 55,7°С;
12% М.с.), бензолом (т.кип. 57,5°С; 39% М.с.), CS2 (т.кип. 37,65°С;
14% М.с.), ССl4 (т. кип. 55,7°С; 20,66 % М.с.) и мн. др. соединениями.
По хим. св-вам М. с.-типичный
одноатомный алифатич. спирт: сочетает св-ва очень слабого основания и еще более
слабой к-ты. С щелочными металлами образует метилаты, напр. CH3ONa,
с к-тами-сложные эфиры (р-ция ускоряется в присут. сильных минер. к-т), напр.
с HNO2 дает метил-нитрит CH3ONO (количественно), с H2SO4
при т-ре ниже 100°С-метилсульфат CH3OSO2OH, с карбоновыми
к-тами-RCOOCH3. Окисляется кислородом воздуха (кат.-Ag, Сu, оксиды
Fe, Mo, V и др.) при 500-600 °С до формальдегида: СН3ОН + 0,5О2
 НСНО +
Н2О; при пропускании паров М.с. над медьсодержащим кат. образуется
метилформиат: 2СН3ОН
НСНО +
Н2О; при пропускании паров М.с. над медьсодержащим кат. образуется
метилформиат: 2СН3ОН НСООСН3
+ 2Н2. Последний получается также при взаимод. М.с. и СО в присут.
ме-тилатов щелочных металлов, а в присут. родиевого кат. и СН3I они
дают уксусную к-ту. При взаимод. со смесью СО и Н2 М. с. превращается
в этанол и др. спирты. Он разлагается водяным паром на катализаторе: СН3ОН
+ Н2О
НСООСН3
+ 2Н2. Последний получается также при взаимод. М.с. и СО в присут.
ме-тилатов щелочных металлов, а в присут. родиевого кат. и СН3I они
дают уксусную к-ту. При взаимод. со смесью СО и Н2 М. с. превращается
в этанол и др. спирты. Он разлагается водяным паром на катализаторе: СН3ОН
+ Н2О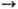 ЗН2
+ + СО2. После очистки от СО2 получают Н2 98%-ной
чистоты. Таким способом производят Н2 в передвижных установках небольшой
мощности.
ЗН2
+ + СО2. После очистки от СО2 получают Н2 98%-ной
чистоты. Таким способом производят Н2 в передвижных установках небольшой
мощности.
При взаимод. с NH3
в присут. дегидратирующих катализаторов М.с. образует метиламины:
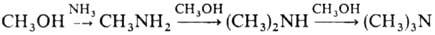
Аррматич. амины метилируются
М. с. в присутствии H2SO4 (200 °С; 3 МПа): C6H5NH2
+ 2CH3OH 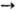 C6H5N(CH3)2+
+ 2Н2О. При 3,5 МПа и 340-380 °С он реагирует с бензолом, образуя
толуол. Дегидратацией М.с. при повышенных т-рах (кат.-Аl2О3)
получают диметиловый эфир: 2СН3ОН
C6H5N(CH3)2+
+ 2Н2О. При 3,5 МПа и 340-380 °С он реагирует с бензолом, образуя
толуол. Дегидратацией М.с. при повышенных т-рах (кат.-Аl2О3)
получают диметиловый эфир: 2СН3ОН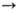 СН3ОСН3
+ Н2О. На высококремнистых цеолитах при 340-450°С М.с. превращается
в парафины и ароматич. углеводороды. С галогеноводородными к-тами, SO2Cl2
или РОСl3 образует метилгалогениды. Взаимод. М. с. с иодом и фосфором
в пром-сти получают метилиодид: 10СН3ОН + 5I2 + 2Р
СН3ОСН3
+ Н2О. На высококремнистых цеолитах при 340-450°С М.с. превращается
в парафины и ароматич. углеводороды. С галогеноводородными к-тами, SO2Cl2
или РОСl3 образует метилгалогениды. Взаимод. М. с. с иодом и фосфором
в пром-сти получают метилиодид: 10СН3ОН + 5I2 + 2Р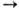 10СН3I + 2Н3РО4 + 2Н2О. При повышенных
т-рах на катализаторе М. с. разлагается на СО и Н2.
10СН3I + 2Н3РО4 + 2Н2О. При повышенных
т-рах на катализаторе М. с. разлагается на СО и Н2.
В пром-сти М.с. получают
гл. обр. каталитич. р-цией из синтез-газа: СО2 + ЗН2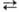 СН3ОН
+ Н2О + 49,53 кДж; образующаяся вода вступает в р-цию: Н2О
+ СО
СН3ОН
+ Н2О + 49,53 кДж; образующаяся вода вступает в р-цию: Н2О
+ СО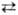 СО2
+ + Н2 + 41,2 кДж. Константа равновесия образования М.с. из СО2
и Н2 с учетом ассоциации паров м. б. рассчитана по ур-нию.
СО2
+ + Н2 + 41,2 кДж. Константа равновесия образования М.с. из СО2
и Н2 с учетом ассоциации паров м. б. рассчитана по ур-нию.
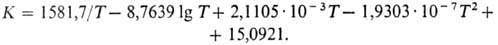
Сырьем для произ-ва М.с.
служат гл. обр. прир. газ и отходы нефтепереработки (см., напр., Газификация нефтяных остатков
), а также коксующийся уголь (см. Газификация твердых топлив
), газы произ-ва ацетилена пиролизом прир. газа и др. До 1960-х гг.
М.с. синтезировали только на цинкхромовом кат. при 300-400 °С и давлении
25-40 МПа. Впоследствии распространение получил синтез М.с. на медьсодержащих
кат. (медьцинкалюмохромовом, медь-цинкалюминиевом или др.) при 200-300°С
и давлении 4-15 МПа.
Совр. технол. схема произ-ва
М. с. из прир. газа включает след. осн. стадии. 1) Очистку прир. газа от соед.
серы гидрироваиием их до H2S, к-рый затем адсорбируют поглотителем-ZnO.
2) Конверсию прир. газа в синтез-газ-в осн. паровую или пароуглекислотную, а
также парокисло-родную или парокислородноуглекислотную. После охлаждения и конденсации
водяных паров газ компримируют.
3) Синтез М. с. Газ, выходящий
из реактора, содержит 3-5% М.с. После охлаждения и конденсации продуктов р-ции
оставшийся газ смешивают с исходным газом и вновь подают в реактор. Метанол-сырец
содержит кроме метанола (94-99% в зависимости от катализатора и условий р-ции)
воду, пропанол, бутиловые и амиловые спирты, диметиловый эфир и др. в-ва, образующиеся
в р-ции.
4) Ректификацию метанола-сырца:
на первой ступени отгоняют легко летучие компоненты, на второй М.с. отделяют
от воды и высококипящих
компонентов. Товарный М.с. содержит обычно 0,08-0,02% воды. В совр. технол.
схемах произ-ва М.с. используются вторичные энергоресурсы.
Применяют М. с. гл. обр.
для произ-ва формальдегида
; его используют также для получения метилметакрилата,
метиламинов, диметилтерефталата, метилформиата, метилхлори-да, уксусной к-ты,
лек. в-в и др., как добавку к бензину (М. с. обладает высоким октановым числом)
и для получения бензина в целях экономии нефтяного сырья. Разрабатываются процессы
получения из М.с. уксусного ангидрида, винилацетата, этанола, ацетальдегида,
этиленгликоля и др. многотоннажных нефтехим. продуктов.
Т. всп. 15,6°С (в открытой
чашке), т. самовоспл. 464 °С, КПВ 6,70-36,5%. М. с.-сильный, преим. нервный
и сосудистый яд с резко выраженным кумулятивным действием; отравление наступает
при приеме внутрь (смертельная доза для человека 30 г, а 5-10 г могут вызвать
тяжелое отравление), вдыхании паров и проникновении через кожу. ПДК 5 мг/м3.
Мировое произ-во ок. 14
млн. т/год (1983).
Впервые М.с. был выделен
из продуктов сухой перегонки древесины Ж. Дюма и Э. Пелиго, к-рые, сопоставив
его св-ва со св-вами винного спирта, дали первые представления о классе спиртов
(1835). В 1857 М. Бертло синтезировал М.с. омылением метилхлорида. Синтетич.
М.с. начали получать с 1923.
Лит.: Караваев М.
М., Мастеров А. П., Производство метанола, М., 1973; Розовский А. Я., "Кинетика
и катализ", 1980, т. 21, в. 1, с. 97-107; Кузнецов В. Д. [и др.], "Теоретические
основы химической технологии", 1977, т. 11, №6, с. 866-71; Островский
В. Е., Дятлов А. А., "Докл. АН СССР" 1982, т. 264, № 2, с. 363-67;
Леонов В. Е., Лободин С. С., "Ж. Всес. хим. об-ва им. Д.И.Менделеева",
1984, т. 29, №4, с. 414-23; Розовский А. Я., Лин Г. И., Теоретические основы
процесса синтеза метанола, М., 1990.
Ю. В. Лендер.
|

