ЭЛЕКТРОДНЫЕ ПРОЦЕССЫ
,
физ.-хим.
процессы, к-рые протекают на границе раздела проводников электрич. тока
1-го и 2-го рода и сопровождаются переходом через эту границу заряженных
частиц - электронов и (или) ионов. При этом в качестве проводников 1-го
рода могут выступать разл. металлы и сплавы, хим. соед., обладающие электронной
проводимостью (напр., оксиды), а также полупроводниковые материалы; в качестве
проводников 2-го рода выступают разл. ионные системы - р-ры и расплавы
электролитов, а также твердые электролиты.
Любой Э. п. всегда протекает в двух направлениях:
в катодном, когда к границе раздела со стороны электрода течет отрицат.
катодный ток (соответствующую плотность тока обозначают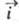 ),
и в анодном, когда к границе раздела со стороны электрода течет положит.
анодный ток (плотность тока
),
и в анодном, когда к границе раздела со стороны электрода течет положит.
анодный ток (плотность тока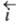 ).
Суммарный Э. п. является катодным, если
).
Суммарный Э. п. является катодным, если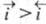 , и анодным, если
, и анодным, если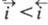 ;
при этом измеряемая плотность тока
;
при этом измеряемая плотность тока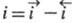 . Катодные процессы связаны с переносом электронов е от электрода к молекулам
или ионам реагирующих на электроде в-в; последние при этом восстанавливаются.
В анодных процессах, наоборот, происходит окисление реагирующих в-в, сопровождающееся
переходом электронов на электрод либо растворением материала электрода.
Хим. превращения в катодном процессе наз. электровосстановлением (напр.,
О2 + 4е + 4Н+
. Катодные процессы связаны с переносом электронов е от электрода к молекулам
или ионам реагирующих на электроде в-в; последние при этом восстанавливаются.
В анодных процессах, наоборот, происходит окисление реагирующих в-в, сопровождающееся
переходом электронов на электрод либо растворением материала электрода.
Хим. превращения в катодном процессе наз. электровосстановлением (напр.,
О2 + 4е + 4Н+ 2Н2О), в анодном - электроокислением (напр., 2Сl-
- 2е
2Н2О), в анодном - электроокислением (напр., 2Сl-
- 2е С12).
В условиях электрохим. равновесия i =i и i = 0.
С12).
В условиях электрохим. равновесия i =i и i = 0.
Обнаружить анодную составляющую катодного
Э. п. можно с помощью радионуклидов. Так, если на амальгаме цинка, содержащей
радионуклид Zn, в неактивном р-ре ZnSO4 проводить катодный Э.
п.
Zn2+ + 2e(Hg) Zn(Hg),
то через нек-рое время р-р также
Zn(Hg),
то через нек-рое время р-р также
обнаруживает радиоактивность из-за наличия .
Закон сохранения массы в ходе Э. п. отражают Фарадея законы
.
.
Закон сохранения массы в ходе Э. п. отражают Фарадея законы
.
Важной особенностью Э. п. является их
стадийный характер. Рассмотрим стадии Э. п. на примере р-ции 2Н3О+
+ 2е(М) Н2
+ 2Н2О (М - металл). В стадии массопереноса ионы Н3О+
из объема р-ра переходят к пов-сти металла М: (Н3О+)об
Н2
+ 2Н2О (М - металл). В стадии массопереноса ионы Н3О+
из объема р-ра переходят к пов-сти металла М: (Н3О+)об (Н3О4)пов.
Затем следует стадия вхождения ионов Н3О+ в двойной электрический слой
(их адсорбция на электроде): (Н3О+)пов
(Н3О4)пов.
Затем следует стадия вхождения ионов Н3О+ в двойной электрический слой
(их адсорбция на электроде): (Н3О+)пов (Н3О+)адс.
После этого имеет место собственно электрохим. стадия разряда-ионизации:
(Н3О+)адс + е(М)
(Н3О+)адс.
После этого имеет место собственно электрохим. стадия разряда-ионизации:
(Н3О+)адс + е(М) Надс
+ Н2О. Удаление адсорбированного водорода с пов-сти электрода
может осуществляться по трем параллельным путям:
Надс
+ Н2О. Удаление адсорбированного водорода с пов-сти электрода
может осуществляться по трем параллельным путям:
1) 2Надс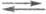 (Н2)пов
(Н2)пов
2) Надс + е(М) + (Н3О+)адс (Н2)пов
+ (Н2О)адс,
(Н2)пов
+ (Н2О)адс,
3) Надс + е(М)
+ (Н2О)адс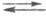 (Н2)пов + (ОН-)адс
(Н2)пов + (ОН-)адс
Путь (1) получил назв. рекомбинации, а
пути (2) и (3) -электрохим. десорбции с участием соотв. ионов Н3О+
и молекул воды. Затем следует стадия массопереноса растворенного Н2
от пов-сти металла в объем р-ра: (Н2)пов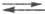 (Н2)об. И, наконец, процесс завершается стадией образования
новой фазы - пузырьков Н2: (Н2)об
(Н2)об. И, наконец, процесс завершается стадией образования
новой фазы - пузырьков Н2: (Н2)об (Н2)газ.
Если же в р-ре имеется к.-л. орг. основание В (напр., пиридин), возникают
дополнит. стадии: хим. взаимодействие - В + Н3О+
(Н2)газ.
Если же в р-ре имеется к.-л. орг. основание В (напр., пиридин), возникают
дополнит. стадии: хим. взаимодействие - В + Н3О+ ВН+
+ Н2О (в объеме р-ра и на пов-сти электрода), разряд адсорбированных
частиц ВН+ и удаление продуктов с пов-сти электрода.
ВН+
+ Н2О (в объеме р-ра и на пов-сти электрода), разряд адсорбированных
частиц ВН+ и удаление продуктов с пов-сти электрода.
Выяснение механизма Э. п. и определение
скоростей как отдельных стадий, так и суммарного Э. п. составляет предмет
электрохимической кинетики
. Э. п. лежат в основе прикладной
электрохимии
.
Лит.: Дамаскин Б.Б., Петрий О. А.,
Введение в электрохимическую кинетику, 2 изд.. М., 1983.
Б. К. Дамаскин.
|

