МОЛЕКУЛЯРНЫЕ КOМПЛЕКСЫ
(донорно-акцепторные комплексы, мол. соединения), образуются из формально
валентно-насыщ. молекул благодаря силам межмолекулярного взаимодействия
.
Совр. представления о М. к. значительно шире того, что заложено в их названии,
т. к. в М. к. могут входить ионы, своб. радикалы, ион-радикалы, а также молекулы
в возбужденном состоянии (см. Эксимеры
, Экси-плексы); к М. к. относятся
и комплексы с водородной связью (см. Водородная связь
). М. к. имеют вполне
определенную стехиометрию и пространств. строение, при этом исходный состав
входящих в М. к. молекул сохраняется. Часто М. к. рассматривают как своеобразный
тип координац. соед., в к-рый
наряду с соед. металлов (см. Металлоорганические соединения
)входят и
комплексы, состоящие исключительно из орг. соед. или неметаллов.
Обычно М. к. отличают от
клатратов
, у к-рых чаще всего менее определенная стехиометрия и энергия
межмолекулярного взаимод. не превышает энергию ван-дер-ваальсова взаимодействия.
Однако это отличие довольно условно, т. к. относит. прочность М. к., по к-рой
они делятся на сильные и слабые, изменяется в весьма широком диапазоне и бывает
соизмерима как с энергией ван-дер-ваальсова взаимод., так и с энергией хим.
связи. Напр., энтальпия образования DH0K для слабого
М. к. (C6H5)2S.I2 всего
-1,25 кДж/моль, а для сильного М. к. 4-C2H5C5H4N.АlВr3
порядка -200 кДж/моль.
Прочность связи и др. физ.-хим.
св-ва М. к. трактуют с позиций образования в них донорно-акцепторной связи,
обусловленной перекрыванием мол. орбиталей (МО) донора (Д) и акцептора (А) электронов
в молекуле М. к.
В соответствии с природой
орбиталей, участвующих в образовании донорно-акцепторной связи, Д и А подразделяют
на неск. групп (Р. Малликен): n-доноры, образующие связь за счет неподеленной
электронной пары гетероатома (напр., амины, эфиры, сульфиды); p-доноры, предоставляющие
p-электроны (напр., ароматич. углеводороды); s-доноры, предоставляющие пару
электронов s-связи (напр., гало-генуглеводороды); u-акцепторы, принимающие электрон
на вакантную орбиталь атома металла (напр., АlНаl3 и др. к-ты Льюиса);
s-акцепторы, предоставляющие разрыхляющую s-орбиталь (галогены); я-акцепторы,
принимающие электрон на p-орбиталь (хиноны, ароматич. нитрилы и карбонильные
соед.). Примеры М. к.: типа nu-R3PO.PF5,
ns-R2S.I2, pu-С6Н6.АlСl3.
Согласно теории Малликена, основное (N)и возбужденное (Е)состояния
М. к. состава ДА описываются соотв. волновыми ф-циями yN и
yE:
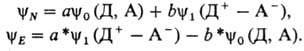
Ф-ция y0 описывает
гипотетич. состояние системы "без связи", когда расстояние между
молекулами Д и А равно длине донорно-акцепторной связи, а взаимод. между ними
только электростатическое. Ф-ция y1 описывает состояние, в к-ром
один из электронов с МО донора yД перенесен без изменения спина на
МО акцептора yД, оставаясь спаренным со вторым электроном на МО yД,
в результате чего образуется ковалентная связь. Суперпозиция гипотетич. состояний,
отвечающих y1 и y0, соответствует реальному состоянию
М. к.
Переход из основного состояния
в возбужденное связан с увеличением вклада состояния y1 (а*
>> b*) и сопровождается резким увеличением степени переноса заряда.
Для ряда М. к. характерно появление в электронных спектрах новой полосы поглощения,
отсутствовавшей в спектрах индивидуальных Д и А, называемой п о л о с о й п
е р е н о с а з а - р
я д а. Не все М. к. имеют полосу переноса заряда, а в ряде случаев
ее трудно фиксировать из-за собств. поглощения Д или
А. Получены линейные ур-ния, связывающие энергию hv, соответствующую
полосе переноса заряда с потенциалом ионизации донора IД для
М. к. типа sn, ss, ps. Наиб. полное полуэмпирич. ур-ние hv = IД
— ЕА + С включает в себя ЕА- сродство
к электрону акцептора и постоянную С.
м. к. часто называют к
о м п л е к с а м и с п е р е н о с о м з а р я д а (КПЗ), хотя перенос заряда
не является единственным или обязательно главным фактором устойчивости М. к.
в основном состоянии. Лишь для М. к. типа pp (p-к о м пл е к с о в), полученных
взаимод. сильных p-доноров и p-акцепторов, уже в основном состоянии реализуется
почти полный перенос заряда и образуются устойчивые ион-радикальные пары, или
и о н-р а д и к а л ь н ы е с о л и, наз. также металлами органическими
,
т.к. их проводимость в определенном температурном интервале близка к металлической.
Синтез таких солей осуществляют целенаправленно, исходя из экспериментально
установленных оптим. значений (IД
- EА) ~ 4 эВ и энергий для полосы переноса заряда hv,
соответствующей l 1000-1500
нм. На основании этих систем ведутся поиски новых оптич. материалов (светофильтров),
материалов с полупроводниковыми сверхпрово-дящими св-вами (напр., ДА, где Д
- тетрахалькогенофульва-лены с Iд ~ 6,3-6,8 эВ и А - тетрацианоэтилен,
циано- и галогенопроизводные дихинонов с EА ~ 1,8-3 эВ). Методом
мёссбауэровской [мессбауэровской] спектроскопии (для твердых быстрозаморо-женных р-ров) установлено
отсутствие переноса заряда в нек-рых слабых М. к. типа ss (напр., ССl4.I2,
С6Н14.I2); заметные значения имеют
величины переноса заряда для М. к. типа ps, пs; макс. значения
переноса заряда (порядка 0,2-0,5 е и выше) наблюдаются в сильных М. к. типа
nu. Такое деление М. к. по величине переноса заряда носит качеств.
характер, т. к. величины переноса заряда, полученные для одних и тех же М. к.
разл. методами (ИК, ЯКР, мёссбауэровской [мессбауэровской], фотоэлектронной спектроскопией, определением
дипольных моментов), часто существенно отличаются друг от друга. Это объясняется
не только разл. условиями эксперимента, но также и тем, что каждый метод связан
с определенными допущениями, роль к-рых не поддается точной оценке. Простая
и наглядная модель М. к. Малликена, породившая множество полуэмпирич. соотношений,
носит качеств. характер. Количеств. теоретич. расчеты М. к. осуществляют методами
МО ЛКАО и ССП МО ЛКАО (см. Молекулярных орбиталей методы
). Выявление
доминирующего фактора в определении прочности М. к. или его структуры проводится
в рамках модельного разложения полной энергии взаимод. (Eвз)
для системы (Д + А) на составляющие:
1000-1500
нм. На основании этих систем ведутся поиски новых оптич. материалов (светофильтров),
материалов с полупроводниковыми сверхпрово-дящими св-вами (напр., ДА, где Д
- тетрахалькогенофульва-лены с Iд ~ 6,3-6,8 эВ и А - тетрацианоэтилен,
циано- и галогенопроизводные дихинонов с EА ~ 1,8-3 эВ). Методом
мёссбауэровской [мессбауэровской] спектроскопии (для твердых быстрозаморо-женных р-ров) установлено
отсутствие переноса заряда в нек-рых слабых М. к. типа ss (напр., ССl4.I2,
С6Н14.I2); заметные значения имеют
величины переноса заряда для М. к. типа ps, пs; макс. значения
переноса заряда (порядка 0,2-0,5 е и выше) наблюдаются в сильных М. к. типа
nu. Такое деление М. к. по величине переноса заряда носит качеств.
характер, т. к. величины переноса заряда, полученные для одних и тех же М. к.
разл. методами (ИК, ЯКР, мёссбауэровской [мессбауэровской], фотоэлектронной спектроскопией, определением
дипольных моментов), часто существенно отличаются друг от друга. Это объясняется
не только разл. условиями эксперимента, но также и тем, что каждый метод связан
с определенными допущениями, роль к-рых не поддается точной оценке. Простая
и наглядная модель М. к. Малликена, породившая множество полуэмпирич. соотношений,
носит качеств. характер. Количеств. теоретич. расчеты М. к. осуществляют методами
МО ЛКАО и ССП МО ЛКАО (см. Молекулярных орбиталей методы
). Выявление
доминирующего фактора в определении прочности М. к. или его структуры проводится
в рамках модельного разложения полной энергии взаимод. (Eвз)
для системы (Д + А) на составляющие: 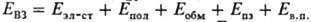 , где Eэл-ст-энергия электростатич. взаимод., Епол
- поляризационная энергия, Еобм - энергия обменного взаимод.,
Епз-энергия, связанная с переносом заряда, Ев.п
-энергия высших порядков, определяемая как разность между Евз
и первых четырех членов разложения. На основании количеств. оценки отдельных
вкладов в Евз, полученной на основе расчетов ab initio (см. Неэмпирические методы
)для широкой серии М. к. разного
типа, К. Морокума классифицировал М. к.: по значениям энергии связи-как сильные
(сотни кДж/моль, типа nu, su), средние (десятки кДж/моль,
типа ns, pp, пp), слабые (единицы кДж/моль, типа ns,
ps, pp); по природе связи (т.е. по наиб. вкладу в Eвз)-как
электростатические, поляризационные, с переносом заряда. При этом М. к. каждого
типа м. б. как сильные, так и слабые. Подобная классификация М. к. весьма условна,
т. к. разделение Eвз на составляющие даже в расчетах ab initio сильно зависит от применяемого в расчете базисного набора волновых
ф-ций. Изучение М. к. имеет важное практич. значение для решения энергетич.
и экологич. проблем - утилизации солнечной энергии, аккумулирования электрич.
энергии, разработки новых методов переработки руд, угля. М. к. используют как
катализаторы, в аналит. химии, электронике, фармакологии, гидрометаллургии и
др. По мнению А. Сент-Дьёр-дя [Сент-Дьер-дя], глиоксалевые производные, обнаруживаемые во всех
живых клетках, являются акцепторами для белков и ответственны за перевод клеток
из анаэробного состояния в аэробное. Затем роль акцептора берет на себя кислород,
к-рый обладает значительно большим, чем глиоксаль, сродством к электрону. Известные
эксперим. факты указывают на важную роль М. к. в ферментативных р-циях в биоэнергетике
в целом.
, где Eэл-ст-энергия электростатич. взаимод., Епол
- поляризационная энергия, Еобм - энергия обменного взаимод.,
Епз-энергия, связанная с переносом заряда, Ев.п
-энергия высших порядков, определяемая как разность между Евз
и первых четырех членов разложения. На основании количеств. оценки отдельных
вкладов в Евз, полученной на основе расчетов ab initio (см. Неэмпирические методы
)для широкой серии М. к. разного
типа, К. Морокума классифицировал М. к.: по значениям энергии связи-как сильные
(сотни кДж/моль, типа nu, su), средние (десятки кДж/моль,
типа ns, pp, пp), слабые (единицы кДж/моль, типа ns,
ps, pp); по природе связи (т.е. по наиб. вкладу в Eвз)-как
электростатические, поляризационные, с переносом заряда. При этом М. к. каждого
типа м. б. как сильные, так и слабые. Подобная классификация М. к. весьма условна,
т. к. разделение Eвз на составляющие даже в расчетах ab initio сильно зависит от применяемого в расчете базисного набора волновых
ф-ций. Изучение М. к. имеет важное практич. значение для решения энергетич.
и экологич. проблем - утилизации солнечной энергии, аккумулирования электрич.
энергии, разработки новых методов переработки руд, угля. М. к. используют как
катализаторы, в аналит. химии, электронике, фармакологии, гидрометаллургии и
др. По мнению А. Сент-Дьёр-дя [Сент-Дьер-дя], глиоксалевые производные, обнаруживаемые во всех
живых клетках, являются акцепторами для белков и ответственны за перевод клеток
из анаэробного состояния в аэробное. Затем роль акцептора берет на себя кислород,
к-рый обладает значительно большим, чем глиоксаль, сродством к электрону. Известные
эксперим. факты указывают на важную роль М. к. в ферментативных р-циях в биоэнергетике
в целом.
Лит.: Гурьянова
Е. Н., Гольдштейн И. П., Ромм И. П., Донорно-ак-цепторная связь, М., 1973; Полещук
О.Х., Максютин Ю.К., "Успехи химии", 1976, т. 45, в. 12, с. 2097-2120;
Молекулярные взаимодействия, под ред. Г. Ратайчика, В. Орвилл-Томаса, пер. с
англ., М., 1984; Успехи химии комплексов с переносом заряда и ион-радикальных
солей (КОМИС-5), под ред. М. Л. Хидекеля, А.В.Булатова, Черноголовка, 1986;
Хобза П., Заград-ник Р., Межмолекулярные комплексы, пер. с англ., М., 1990;
Mulliken R. S., Person W. В., Molecular compounds, N.Y., 1969. См. также лит
.
при статьях Межмолекулярные взаимодействия
, Металлы органические
. В. А. Коган.
|

