МОЧЕВИНА
(диамид
угольной к-ты, карбамид) (NH2)2CO, мол. м. 60,06; бесцв.
кристаллы без запаха; кристаллич. решетка тетрагон. (а = 0,566 нм, b=
0,4712 нм, z = 2, пространств. группа P421m); претерпевает
полиморфные превращ.; т.пл. 132,7 °С; плотн. 1330 кг/м3 (25 °С);
пD20 1,484; С° 93,198 ДжДмоль.
К); DG0обр - 197,3 кДж/моль, DН0обр
-333,3 кДж/моль, DН0сгор - 632,5 кДж/моль, DН0пл
14,53 кДж/моль, S0298 104,67 ДжДмоль.К);
m 14,0.10-30 Кл.м (вода, 25 °С); К 1,5.10-14
(вода, 25 °С). Для расплава плотн. 1225 кг/м3; h 0,00258
Па.с; g 0,036 Н/м; теплопроводность (135°С) 0,42 Вт/(м.К);
р 2,3 Ом.м. Р-римость (г в 100 г р-рителя): в воде-51,8 (20°С),
71,7 (60°С), 95,0 (120°С); в жидком NH3-49,2 (20°С, 709
кПа), 90 (100 °С, 1267 кПа); в метаноле-22 (20 °С); в этаноле-5,4 (20
°С); в изопропано-ле-2,6 (20 °С); в изобутаноле-6,2 (20 °С); в этилацетате-0,08
(25 °С); не раств. в хлороформе. Молекула М. имеет плоское строение.
М. образует соед. включения
с неорг. и орг. в-вами, напр. CO(NH2)2.NH3,
CO(NH2)2 • Н3РО4, CO(NH2)2.H2O2,
CO(NH2)2.CH3OH и др.
При натр. до 150°С
и выше М. последовательно превращ. в NH4NCO, NH3, CO2,
биурет, циануровую к-ту; в замкнутом сосуде, особенно при добавлении NH3,-продукты
ами-нирования циануровой к-ты, напр. меламин. В разбавленных р-рах при ~ 200
°С возможен полный гидролиз М. с образованием NH3 и СО2.
Гидролиз ускоряется в присут. к-т и щелочей, а также под действием фермента
уреазы, находящегося во мн. организмах и семенах нек-рых растений (соевые бобы
и др.).
В расплавленном виде М.
реагирует со щелочными металлами и их амидами с образованием солей цианамида.
При сплавлении с содой разлагается до NaNCO, CO2, NH3
и Н2О; при сплавлении с NH4NO3 в присут. SiO2
образуется гуанидин; при взаимод. с хлорсульфокислотами-амидо-сулъфокислоты;
с конц. олеумом-сульфаминовая к-та; с (СН3СО)2О при 140°С-ацетамид
и диацетамид (при 60 °С в присут. Н2SО4-ацетилмочевина);
с хлором на холоду -N-хлор- и N,N-дихлормочевина NH2CONHCl и CO(NHCl)2;
с бромом-циануровая к-та; с NaClO-гидразин; с CS2 (110°C)-NH4SCN
и COS. К действию Н2О2 и KMnO4 M. устойчива.
При алкилировании М. образуются
алкилзамещенные М. RNHCONH2; при действии спиртов -уретаны NH2COOR;
при взаимод. с карбоновыми к-тами, их ангидридами, хлор-ангидридами и сложными
эфирами-уреиды RCONHCONH2; с двухосновными к-тами-циклич. уреиды,
напр. с натрий-малоновым эфиром в спиртовом р-ре—барбитуровая к-та; с ангидридами
ароматич. двухосновных к-т-соответствующие имиды, напр. с фталевым ангидридом
при 156°С-фталимид; с аминами - высокомол. продукты поликонденсации типа
NH2(CH2)n[NHCONH(CH2)n]m;
с анилином - фенил- и дифе-нилмочевины; с гидразином-семикарбазид NH2CONHNH2
и гидразоформамид (NH2CONH)2. М. легко конденсируется
с формальдегидом, образуя мочевино-формалъдегидные смолы. В нек-рых р-циях
проявляется таутомерная форма М.-изомочевина NH2C(OH)=NH; напр.,
при взаимод. гидрохлорида цианамида со спиртами образуются О-алкило-вые эфиры
изомочевины.
М.-конечный продукт белкового
обмена у мн. беспозвоночных и большинства позвоночных животных (рыб, земноводных,
млекопитающих) и человека. Биосинтез М. из конечных продуктов распада белков
(NH3, CO2) протекает в печени в результате ряда ферментативных
р-ций, замкнутых в цикл (цикл М., или орнитиновът цикл). М. участвует
в регуляции водного режима животных. Из организма выводится почками в виде мочи
и потовыми железами (человек выделяет 25-30 г М. в сутки). У животных содержится
в небольших кол-вах в мышцах, крови, лимфе, слюне, молоке, слезах, обнаружена
в тканях растит. организмов (грибы, нек-рые высшие растения).
В пром-сти М. получают
по р-ции Базарова:
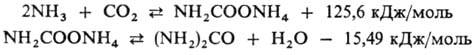
Произ-во М. включает стадию
синтеза, осуществляемого при 180-230 °С и давлении 12-25 МПа, рецикл непрореагировавших
в-в в виде аммониевых солей угольной к-ты, стадии обезвоживания р-ров М. и приготовления
товарных форм (кристаллы, гранулы). В совр. технологии широко применяют дистилляцию
в токе СО2 или NH3, позволяющую значительно повысить экономичность
процесса. Разработаны научно-техн. решения для создания безотходного и энергосберегающего
произ-ва М. с единичной мощностью агрегатов 450 тыс. т/год и более.
Препаративных методов синтеза
М. известно более пятидесяти; напр., взаимод. NH, с СОСl2, COS или
СО, ацетиленом или бензолом на Pt; окислением цианида калия КМnО4
или NaClO; нагреванием СО в медноаммиачном р-ре под давлением; гидролизом Pb(CN)2
кипящей водой и др.
Для количеств. определения
М. гидролизуют в присут. H2SO4 или уреазы и определяют
NH3. Для обнаружения М. используют появление желто-зеленого окрашивания
при взаимод. р-ра М. с n-диметиламинобензальдегидом в присут. НСl; ниж.
предел определения М. в фотометрируемом объеме 2 мг/л.
М. применяют в качестве
концентрир. азотного удобрения (содержит ок. 46% N) для мн. с.-х. культур на
любых почвах, а также как заменитель естеств. белка в кормах для жвачных животных.
Производные М.-эффективные гербициды. М.-сырье для синтеза ценных хим. продуктов:
карбамидных смол, меламина, циануровой к-ты и ее эфиров, NaCN, KCN, гидразина,
гидразоформамида, а также фармацевтич. препаратов (веронала, люминала, бромурала
и др.), нек-рых красителей. В нефтяной пром-сти М. используют для де-парафинизации
масел и моторных топлив с выделением мягкого парафина-сырья для получения белково-витамин-ных
препаратов, жирных спиртов и к-т, моющих ср-в и т. п.
Мировое произ-во 106 млн.
т/год (1984).
М. открыта И. Руэлем (1773)
в моче, идентифицирована У. Праутом (1818), впервые синтезирована Ф. Вёлером [Велером]
(1828) из цианата аммония, что нанесло первый удар по витализму-учению о т.
наз. жизненной силе.
Лит.: Кучерявый
В. И., Лебедев В. В., Синтез и применение карбамида, Л., 1970; Кучерявый В.
И., Горловский Д. М., Альтшулер Л. Н., Технология карбамида, Л., 1981; Кучерявый
В. И., Горловский Д. М., "Ж. Всес. хим. об-ва им. Д. И. Менделеева",
1983, № 4, с. 47-54.
В. И. Кучерявый, Ю.
А. Сергеев.
|

