ЭЛЕКТРОДНЫЙ ПОТЕНЦИАЛ
,
разность
электростатич. потенциалов между электродом и находящимся с ним в контакте
электролитом. Возникновение Э. п. обусловлено пространств. разделением
зарядов противоположного знака на границе раздела фаз и образованием
двойного электрического слоя
. На границе между металлич. электродом и р-ром
электролита пространств. разделение зарядов связано со след. явлениями:
переносом ионов из металла в р-р в ходе установления электрохим. равновесия,
кулоновской адсорбцией ионов из р-ра на пов-сть металла, смещением электронного
газа за пределы положительно заряженного ионного остова кристаллич. решетки,
специфич. (некулоновской) адсорбцией ионов или полярных молекул р-рителя
на электроде и др. Последние два явления приводят к тому, что Э. п. не
равен нулю даже при условиях, когда заряд пов-сти металла равен нулю (см. Потенциал нулевого заряда
).
Абс. величину Э. п. отдельного электрода
определить невозможно, поэтому измеряют всегда разность потенциалов исследуемого
электрода и нек-рого стандартного электрода сравнения
.
Э. п. равен
эдс электрохим. цепи, составленной из исследуемого и стандартного электродов
(диффузионный потенциал
между разными электролитами, обусловленный
различием скоростей движения ионов, при этом должен быть устранен). Для
водных р-ров в качестве стандартного электрода обычно используют водородный
электрод (Pt, Н2[0,101 МПа] | Н+[a= 1]), потенциал
к-рого при давлении водорода 0,101 МПа и термодинамич. активности
а ионов Н+ в р-ре, равной 1, принимают условно равным нулю
(водородная шкала Э. п.). При схематич. изображении цепи водородный электрод
всегда записывают слева; напр., потенциал медного электрода в р-ре соли
меди равен эдс цепи Pt, H2|HCl CuCl2|Cu|Pt
(две штриховые черты означают, что диффузионный потенциал на фанице НС1
и СuС12 устранен).
CuCl2|Cu|Pt
(две штриховые черты означают, что диффузионный потенциал на фанице НС1
и СuС12 устранен).
Если исследуемый электрод находится в
стандартных условиях, когда активности всех ионов, определяющих Э. п.,
равны 1, а давление газа (для газовых электродов) равно 0,101 МПа, значение
Э. п. наз. стандартным (обозначение E°).
Оно связано со стандартным изменением
энергии Гиббса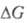 и константой равновесия Кр электрохим. р-ции ур-нием:
и константой равновесия Кр электрохим. р-ции ур-нием: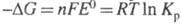 , где F - число Фарадея; п - число электронов, участвующих
в р-ции; R - газовая постоянная; Т - абс. т-ра. Значения
E°
электрохим. систем по отношению к водородному электроду и протекающие на
электродах р-ции сведены в спец. таблицы (подробнее см. Стандартный потенциал
).
, где F - число Фарадея; п - число электронов, участвующих
в р-ции; R - газовая постоянная; Т - абс. т-ра. Значения
E°
электрохим. систем по отношению к водородному электроду и протекающие на
электродах р-ции сведены в спец. таблицы (подробнее см. Стандартный потенциал
).
Зависимость Э. п. от термодинамич. активностей
ai участников электрохим. р-ции выражается
Нернста уравнением
:
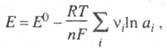
где vi - стехиометрич.
коэф. участника р-ции, причем для исходных в-в это отрицат. величина, а
для продуктов р-ции -положительная.
Если через электрод протекает электрич.
ток, Э. п. отклоняется от равновесного значения из-за конечной скорости
процессов, происходящих непосредственно на границе электрод - электролит
(см. Поляризация
).
Лит.: Корыта И., Дворжак И., Богачкова
В., Электрохимия, пер. с чеш., М., 1977; Антропов Л. И., Теоретическая
электрохимия, 4 изд., М., 1984; Дамаскин Б. Б., Петрий О. А., Электрохимия,
М., 1987; Багоцкий B.C., Основы электрохимии, М., 1988; Практикум по электрохимии,
под ред. Б. Б. Дамаскина, М., 1991.
О. А. Петрий.
|

