МУТАГEНЫ
(от мутации
и греч. -genes-рождающий, рожденный), хим. и физ. факторы, вызывающие наследств.
изменения - мутации. Впервые
искусств. мутации получены в 1925 Г. А. Надсе-ном и Г. С. Филипповым у дрожжей
действием радиоактивного излучения радия; в 1927 Г. Мёллер [Меллер] получил мутации у
дрозофилы действием рентгеновских лучей. Способность хим. в-в вызывать мутации
(действием иода на дрозофилы) открыта в 1932 В. В. Сахаровым.
М. химические. Различают
М. прямого действия -соед., реакц. способность к-рых достаточна для хим. модификации
ДНК, РНК и нек-рых белков, и промутагены - в-ва, к-рые сами по себе инертны,
но превращ. в организме в М. (в осн. в результате ферментативного окисления
системой микро-сомных многоцелевых оксидаз). Последние часто называют "конечными"
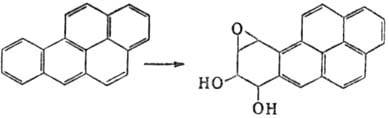
М. Так, немутагeнный 1,2-бензопкрен (бен-зо[а]пирен) в организме окисляется
до 7,8-дигидрокси-9,10-эпокси-7,8,9,10-тетрагидро-1,2-бензопирена, один из стерео-изомеров
к-рого обладает мутагенной, а также канцерогенной активностью:
Др. пример - немутагенный
N-нитрозодиметиламин, к-рый в печени подвергается ферментативному окислит. деметили-рованию
и превращ. в высокомутагенный и канцерогенный метилдиазогидроксид (см. Канцерогенные вещества
).
Мишенью действия М. в клетке
являются гл. обр. ДНК и, возможно, нек-рые белки. К последним относят в осн.
белки, играющие структурную роль в организации генома или принимающие участие
в репликации (самовоспроизведении молекулы нуклеиновых к-т), рекомбинации (перераспределении
генетич. материала родителей в потомстве) или репарации (восстановлении поврежденной
структуры ДНК).
Среди М. наиб. обширен
класс электроф. алкилирующих М., к к-рым относят не только типичные алкилирующие
агенты (диазоалканы, эфиры серной к-ты и алкансульфо-кислот), но и эфиры фосфорной
и азотной к-т, аминоэтили-рующие реагенты (2-хлорэтиламин, этиленимин и их производные),
оксиэтилирующие агенты (этиленоксид и его производные) и альдегиды. К этому
же классу М. относят N-нитрозо-N-алкиламиды карбоновых к-т, N-нитрозо-N-алкилуретаны,
N-нитрозо-N-алкилмочевины, N-алкил-N-нитрозо-N-нитрогуанидины,
являющиеся, по-видимому, наиб. активными из известных М. Эти соед. сами по себе
лишены алкилирующих св-в, но при их гидролитич. распаде образуются активные
алкилдиазогидрохсиды (иногда считают, что образуются своб. алкилкарбкатионы,
что менее вероятно).
Электроф. реагентами являются
также подавляющее большинство конечных М., образующихся из синтетич. и прир.
в-в. Пример последних - глюкозид циказин (b-D-глю-козид метилазоксиметанола),
к-рый под действием ферментов трансформируется в метилдиазогидроксид.
Механизм мутагенного действия
простейших алкилирующих агентов довольно хорошо изучен. Характер повреждений
ДНК при воздействии этих агентов м.б. предсказан с помощью ф-лы Свена-Скотта:
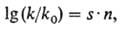
где k- константа
скорости бимолекулярной р-ции алкили-рующего агента с нуклеофилом; k0
- константа скорости бимолекулярной р-ции алкилирующего агента с водой, выбранной
в качестве стандарта; n-константа, характеризующая нуклеофильность субстрата;
.s-мера чувствительности скорости р-ции к изменению п.
Из ф-лы следует, что при
алкилировании биополимеров, имеющих неск. нуклеоф. центров, доля продуктов алкили-рования
центра с низкой нуклеофильностью должна быть выше при действии агента с низкой
константой s.
Наибю нуклеоф. центр в
молекуле ДНК-положение 7 в гуанине. Поэтому диметилсульфат и метилметансульфоиат
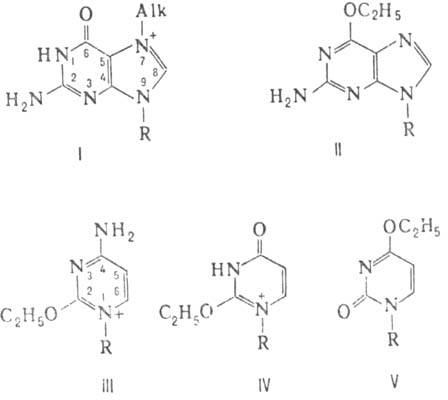
(s соотв. 0,9 и 0,86) алкилируют ДНК в осн. по этому положению (см. ф-лу I; везде R-цепь ДНК), а выход продуктов алкилирования центров с меньшей нуклеофильностыо
мал. При действии на ДНК этилметансульфоната и N-нитрозо-N-метилмочевины (s соотв. 0,67 и 0,42) доля 7-алкилгуанина в общем выходе продуктов алкилирования
снижается и возрастает вклад продуктов алкилирования центров с низкой нуклеофильностью
- межнуклеотидных фосфатных групп и атомов кислорода в основаниях. При алкилировании
ДНК N-нитрозо-N-этилмочевиной (s ок. 0,26) осн. продукт р-ции -алкилир.
остатки фосфорной к-ты и О-алкилир. основания: О6-этилгуанин (II),
О2-этилцитозин (III), О2- и О4-этилтимины (соотв.
IV и V).
Синтез новой нити ДНК на
ДНК-матрице, содержащей 7-алкилгуаниновые звенья, проходит без ошибок и мутаций
не возникает. Напротив, полинуклеотид, синтезированный на матрице, содержащей
О-алкилир. звенья, содержит ошибочно включенные пуриновые и пиримидиновые основания.
С возрастанием способности к О-алкилированию у простейших алкилирующих агентов
возрастает канцерогенная активность.
Мутации, возникающие при
действии метилметансульфо-ната, не алкилирующего основания ДНК по атому О, являются
следствием ошибок работы ферментов клетки, восстанавливающих исходное (неизмененное)
состояние ДНК.
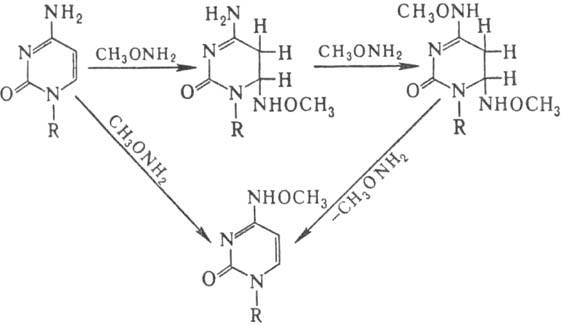
Спектр повреждений ДНК
при действии нуклеоф. мутаге-нов (гидроксиламин, О-метилгидроксиламин, гидразины,
бисульфит Na) значительно уже. В осн. это модификация цитозина, направление
и механизм к-рой иллюстрирует след. схема:
Др. нуклеоф. агенты реагируют
аналогично, но константы скорости отдельных стадий могут существенно меняться.
Особенность действия бисульфита на ДНК-замена цитози-новых звеньев на урацилъные
в результате дезаиминирова-ния цитозина по схеме:
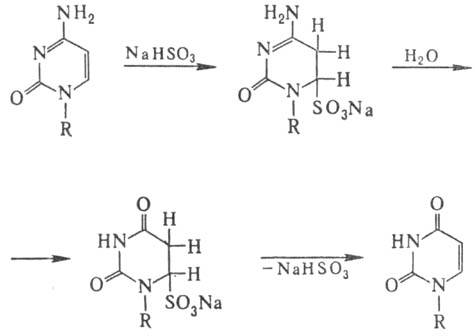
Ряд М. вызывают мутации,
не связываясь ковалентно с ДНК. Так, нек-рые гетероциклич. соед. (напр., акридин
и его производные), обладающие жесткой плоской структурой молекулы, встраиваются
(интеркалируют) между смежными, расположенными стопкой, парами оснований двойной
спирали ДНК. В этом случае матричный синтез на ДНК протекает с ошибками. В синтезируемой
нити ДНК оказывается на один нуклеотид больше или меньше обычного и возникают
мутации.
Особый класс М. составляют
соед., представляющие со-бой аналоги оснований ДНК-5-галогенурацилы, 2-амино-и
6-метиламинопурины и др. Галогенурацилы включаются в ДНК при матричном синтезе
вместо тимина, 2-амино-пурин-вместо аденина. Вследствие различий в положении
кетоенольного равновесия у тимина и галогенурацилов (при включении последних
в ДНК) увеличивается частота ошибочных спариваний оснований и возникают ошибки
при репликации.
Существуют также М., ингибирующие
синтез предшественников ДНК. Мишень таких М.-ферменты, синтезирующие компоненты
ДНК. Считается, что в результате подавления синтеза предшественников происходит
замедление или даже остановка синтеза ДНК. В этих условиях повышается вероятность
того, что решшкац. система клетки может пропустить отсутствующий нуклеотид,
либо включить вместо
отсутствующего нуклеотида другой, ошибочный; следствие обоих событий-мутация.
Мутагенные и канцерогенные
св-ва хим. в-в тесно связаны между собой. Поэтому выявление возможных М. в окружающей
среде, испытание на мутагенность продуктов пром. синтеза (красители, лек. ср-ва,
пестициды и др.)-важная задача совр. генетики. Разработаны тест-системы для
экспресс-обнаружения М. Наиб. часто используют тест Б. Эймса и его модификации.
Для их осуществления используют специально полученные штаммы бактерий Salmonella
typhimurium, к-рые не способны синтезировать гистидин из-за генетич. нарушений.
Этот штамм поэтому не может расти в среде, в к-рой отсутствует эта аминокислота.
Др. его особенность-способность в результате обратной мутации приобретать исходную
способность синтезировать гистидин из обычных предшественников (NH3
и др.). Частота обратных мутаций заметно увеличивается под действием М. и может
служить критерием их активности. В тестах используют лишенную гистидина питат.
среду, в к-рую добавляют экстракт из печени крыс, содержащий ферменты эндоплаз-матич.
ретикулума, способные превращать в-во в мутаген-ную (канцерогенную) форму. В
случаях, когда в-во обладает мутагенной активностью, наблюдается активный рост
колоний бактерий. Время тестирования-ок. 24 ч (на тестирование с использованием
эксперим. животных затрачивается 2-3 года).
М. физические. Мутации
при действии физических М. возникают так же, как и при действии М. химических.
Вначале возникает первичное повреждение ДНК. Если оно не будет полностью исправлено
в результате репарации, то при послед. репликативном синтезе ДНК будут возникать
мутации. Специфика мутагенеза (процесса возникновения мутаций) при действии
физ. факторов связана с характером первичных повреждений генома, вызываемых
ими.
Подробно изучены повреждения
ДНК, возникающие в результате действия электромагн. излучения разной длины волны.
Электромагн. излучение с длиной волны больше 300 нм не поглощается ДНК, однако
в нек-рых случаях может оказывать мутагенное действие, механизм к-рого заключается
в поглощении кванта света молекулой сенсибилизатора и передачей энергии возбуждения
на ДНК. При действии света с длиной волны 200-300 нм (lмакс поглощения
ДНК 260 нм) происходит поглощение квантов света хромофорными группами ДНК (пуриновые
и пиримидиновые основания) и переход последних в возбужденное состояние. В обоих
случаях б.ч. поглощенной энергии рассеивается и основания ДНК возвращаются в
исходное, невозбужденное, состояние, но часть возбужденных оснований подвергается
фотохим. трансформации.
В наиб. степени это относится
к тимину, остальные основания более устойчивы. Энергия излучения, поглощенная
тимином, локализуется в осн. на двойной связи цикла; следствием этого является
образование в составе ДНК димеров:
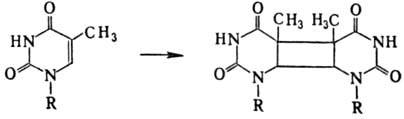
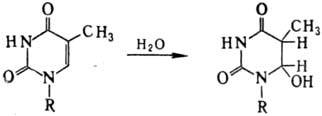
Возбужденная двойная связь
способна также присоединять нуклеофилы с образованием, напр., нестойкого гидрата
тимина:
При облучении ДНК дальним
УФ светом (185 нм) возможно и фотоокисление тимина с образованием его гидроперок-сида
(ф-ла VI).
Предполагают, что осн.
предмутац. повреждение ДНК, возникающее
при действии УФ света, связано с образованием димеров тимина.
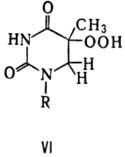
Электромагн. излучения
еще более высокой энергии (рентгеновское
и у-излучение) способны ионизовать в-во. Ионизация происходит случайным образом,
поэтому молекулы, являющиеся наиб.
распространенными в объекте, больше других под вергаются ионизации. При
облучении живой материи, на 70-90% состоящей из воды, б. ч. энергии будет поглощена
молекулами воды и поэтому мутагенный эффект при действии этих агентов возникает
гл. обр. вследствие модификации ДНК продуктами радиолиза воды. Наиб. вклад в
развитие радиац. поражения ДНК вносит радикал ОН.. При взаимод. с
ДНК 80% всех радикалов ОН. атакуют основания ДНК, остальные-дезоксирибозную
часть молекулы. Возникающие первичные продукты затем вступают в разнообразные
вторичные р-ции как с теми же продуктами радиолиза воды, так и с кислородом,
белками, низкомол. компонентами клетки, а также подвергаются диспропорционированию,
изомеризации, гидролизу. Возникает широкий спектр разнообразных изменении первичной
и вторичной структуры ДНК: измененные основания, апури-новые и апиримидиновые
сайты (участки с удаленными основаниями), разрывы связей в дезоксирибозе, одно-
и двунитевые разрывы цепей ДНК. Точная роль каждого из возникающих повреждений
структуры ДНК в формировании мутагенного эффекта все еще остается невыясненной.
Предполагают, что ключевую роль в этом процессе играют продукты радиолиза тимина.
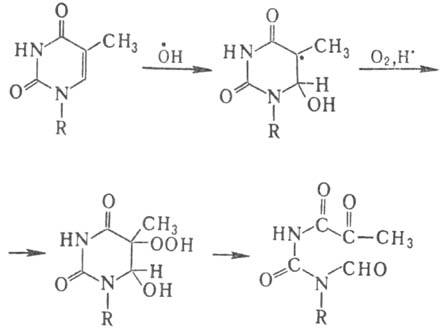
В тимине первичной атаке
радикалом ОН. подвергается двойная связь цикла с образованием двух
радикалов с радикальными центрами в положениях 5 и 6, с преобладанием первого.
В присут. кислорода из радикала образуется гидро-пероксид, к-рый уже при комнатной
т-ре разлагается с раскрытием цикла:
Радиационно-хим. изменения
цитозина также протекают через стадию образования аналогичного, но еще более
нестабильного гидропероксида. В случае цитозина и аденина возможно также дезаминирование
оснований. Пуриновые основания (аденин, гуанин) реагируют с радикалом ОН.
с меньшей скоростью. Идентифицированы, напр., продукт гидроксилирования аденина
(8-гидроксиаденин), а также продукты раскрытия имидазольного кольца этих оснований.
В дезоксирибозном остатке
молекулы ДНК радикал ОН. способен атаковать и отрывать атом Н из
любого положения цикла. Конечный результат радиационно-хим. модификации этой
части молекулы ДНК - образование малонового диальдегида, сопровождающееся разрывом
N-гликозидной связи
с отщеплением неизмененного основания, и, в итоге, однонитевых разрывов ДНК.
Затем уже возникают и двунитевые разрывы ДНК в результате статистич. накопления
однонитевых разрывов в противоположных участках двух цепей ДНК.
Известно прямое действие
радиации на молекулы-мишени, в результате к-рого макромолекулы превращ. в своб.
радикалы по схеме:
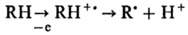
Судьба образовавшихся радикалов
R., вероятно, схожа с судьбой радикалов, возникающих при непрямом
действии радиации.
Механизм действия др. видов
ионизирующего излучения (a-частицы, протоны, нейтроны, электроны, ускоренные
ядра более тяжелых элементов) близок к механизму действия ионизирующего электромагн.
излучения. Отличия обусловлены гл. обр. разницей в массе, заряде, энергии и
глубине проникновения излучения в объект, способом ионизации макромолекул и
др. Имеются сведения, что воздействие нек-рых др. физ. факторов, напр. звуковых
колебаний, вибрации, могут также привести к мутации.
М. применяют для получения
штаммов микроорганизмов, продуцирующих в больших кол-вах антибиотики, аминокислоты,
витамины и др. в-ва, чем прир. штаммы (такие штаммы используют в пром-сти),
а также для выведения новых сортов растений.
Лит.: Первичные
радиобиологические процессы, под ред. Н. В. Тимофеева-Ресовского, 2 изд., М.,
1973; Рябченко Н.И., Радиация и ДНК, М., 1979; КогглД., Биологические эффекты
радиации, пер. с англ., М., 1986; Рубин А.Б., ФрайкинГ.Я., "Успехи совр.
биологии", 1987, т. 103, в. 3, с. 323-39; Chemical mutagens. Principles
and methods for their detection, ed. by A. Hollander, v. 1-10, N.Y., 1971-86.
A.M. Серебряный.
|

